https://doi.org/10.21068/c2019.v20n02a02
Impactos del cambio climático sobre la flora acuática de las Lagunas Verdes, volcán Chiles, Ecuador
Impacts of climate change on the aquatic flora of Lagunas Verdes, Chiles Volcano, Ecuador
Esteban Terneus Jácome
Universidad Internacional del Ecuador
Quito, Ecuador
Berenice Vallejo
Universidad Internacional del Ecuador
Quito, Ecuador
Mateo Gómez de la Torre
Universidad Internacional del Ecuador
Quito, Ecuador
Recibido: 8 de noviembre de 2018
Aceptado: 29 de julio de 2019
Resumen
Evaluamos los impactos del cambio climático sobre la estructura y composición florística de las plantas acuáticas en cinco lagunas altoandinas (3900 m s. n. m.), al pie del volcán Chiles. Utilizamos transectos y cuadrantes de profundidad para evaluar riqueza y patrones de cobertura vegetal, y evaluamos la físicoquímica de agua con equipos electrónicos de medición in situ. Esta información fue comparada con la generada hace 17 años. Registramos 15 especies de plantas acuáticas, de las cuales se evidenció reducción en las poblaciones de Isoetes sp., Crassula venezuelensis y Elatine ecuadoriensis. Al parecer, Lilaeopsis schaffneriana y Juncus stipulatus son remplazadas por Lachemilla nivalis, y una Poaceae del género Agrostis como colonizadora. Las características abióticas de las lagunas evidencian cambios en el pH y la conductividad de sus aguas, generando condiciones particulares para un posible establecimiento de especies distintas a los registros históricos. Evidenciamos perjuicios sobre la naturaleza del ecosistema acuático, por la pérdida o reemplazo de especies hidrófitas por helófitas, como indicadoras de un potencial proceso de transformación de ambientes naturales, y un inminente riesgo de la permanencia y la funcionalidad ecológica de los ecosistemas acuáticos del lugar.
Palabras clave. Ecosistema Acuático. Helófitas. Hidrófitas. Plantas acuáticas. Poblaciones. Vulnerabilidad.
Abstract
We evaluated the impact of climate change on the structure and floral composition of the aquatic plants occurring in five Andean lakes (3900 m a. s. l.) at the foot of the Chiles Volcano. We obtained field information using transects and depth quadrants to evaluate richness and cover vegetation patterns, whereas physical chemistry of water was evaluated using electronic measuring equipment in situ. Part of the information from the same lakes 17 years ago was used as a basis for comparison. Were recorded fifteen species of aquatic plants, with evidence of a reduction in the populations of Isoetes sp., Crassula venezuelensis and Elatine ecuadoriensis. Apparently, Lilaeopsis schaffneriana and Juncus stipulatus were replaced by Lachemilla nivalis and a Poaceae of the genus Agrostis as a colonizer. The abiotic characteristics of the lakes show changing trends in pH and conductivity of the waters, turning them more neutral than acidic. This leads to conditions that may allow for the establishment of species other than those of historical records, increasing the general variety, implying the possibility that climate change effects are not necessarily negative in this situation. However, there is evidence of damage to the natural aquatic ecosystem, through the loss or replacement of hydrophilic for halophile plants. This potential transformation process of the natural environment jeopardizes the ecological functioning of the aquatic ecosystems in the area.
Keywords. Aquatic Ecosystems. Aquatic Plants. Helophytes. Hydrophites. Populations. Vulnerability.
Introducción
Uno de los factores para medir los impactos del cambio climático sobre las especies es la vulnerabilidad de las mismas a los cambios ambientales (Dawson et al., 2011). En los ecosistemas acuáticos en particular, esta vulnerabilidad se presenta con mayor fuerza por la sensibilidad de las especies a las variaciones del medio, lo cual puede producir cambios en la estructura poblacional, en los patrones de asociación a nivel de comunidad, hasta el reemplazo y desaparición de especies locales (Dawson et al., 2011).
La vulnerabilidad, entendida como la susceptibilidad del sistema a los impactos negativos, se expresa en tres componentes: exposición, sensibilidad y capacidad adaptativa de las especies a los cambios en su hábitat (Foden et al., 2013). Estos componentes tienen efectos a escala local, regional y global.
La exposición hace referencia a la magnitud del cambio climático (temperatura, precipitación, variaciones de nivel de agua y otros) en hábitats y ecosistemas ocupados por las especies. Mientras tanto, la sensibilidad está determinada por factores intrínsecos, incluyendo límites de tolerancia ecológica a los que se hace referencia en este estudio (Williams et al., 2008). Finalmente, la capacidad adaptativa hace referencia a la capacidad de las especies de subsistir en el lugar, y está condicionada a factores intrínsecos como plasticidad fenotípica, diversidad genética, factores evolutivos, ciclos de vida y habilidades de dispersión y colonización de ambientes (Dawson et al., 2011).
Investigaciones recientes demuestran los impactos del cambio climático sobre las poblaciones de peces (Kwon et al., 2015; Pandit et al., 2017) y bentos marinos (Jiao at al., 2015; Göransson, 2017), particularmente sobre los patrones de distribución y migración.
Sin embargo, no existe información suficiente relacionada al impacto del cambio climático sobre especies de agua dulce y sobre todo en aquellos gremios de productividad primaria, como la vegetación acuática de las lagunas altoandinas, asentadas en los trópicos, donde el impacto del cambio climático se manifiesta con mayor fuerza hacia las zonas altoandinas de la línea ecuatorial (Thomas et al., 2004).
Si bien es cierto que la capacidad adaptativa de las especies frente a los cambios ambientales puede manifestarse a mediano y largo plazo, existen especies cuyo umbral de sensibilidad responde de forma más acelerada, dependiendo de la estructura física y fisiológica del organismo hacia las condiciones del medio (Fjerdinstad et al., 2007). Este es el caso particular del medio acuático, donde las especies son más sensibles a este tipo de cambios (Dos Santos Fonseca et al., 2015), y las primeras manifestaciones se reflejan en la estructura y composición de las comunidades acuáticas. Varias especies en este contexto muestran limitaciones de dispersión de semillas, bajos umbrales de adaptabilidad a las nuevas condiciones del medio, razones que conducen a una potencial reducción de las poblaciones e inclusive a la desaparición de especies en un ambiente particular (Göransson, 2017). Las proyecciones del cambio climático en los altos Andes para el presente siglo pronostican variaciones fuertes de temperatura, con los consecuentes efectos sobre la biodiversidad (Urrutia & Vuille, 2009; Pounds et al., 1999).
En las Lagunas Verdes ubicadas al pie del volcán Chiles, en el límite entre Ecuador y Colombia, está evidenciándose un fenómeno particular ligado a las variaciones de las condiciones ambientales de estos cuerpos de agua, posiblemente atribuibles al cambio climático, manifiestos en la composición química del agua y en la estructura y composición florística de la vegetación acuática de las especies que habitan en estos ecosistemas naturales.
La comparación de estudios previos (Terneus, 2001; Terneus, 2002) con la presente investigación, pretenden demostrar algunos cambios estructurales en las especies, a pesar de los bajos niveles de intervención e impacto humano en el lugar. Estos cambios se reflejan en la reducción de poblaciones, trastornos en las condiciones del hábitat y aparición de nuevas especies, dejando al descubierto la gran vulnerabilidad de estos ambientes, con la consecuente trasformación ecológica y la potencial desaparición de los mismos.
Materiales y métodos
Área de estudio. Las Lagunas Verdes se hallan ubicadas al pie del volcán Chiles (00°47´50´´N - 77°55´46´´O) a 3900 m s. n. m., en la frontera con Colombia, en la ruta que conecta los poblados de Tufiño con Maldonado, en la provincia del Carchi (Figura 1 y 2).
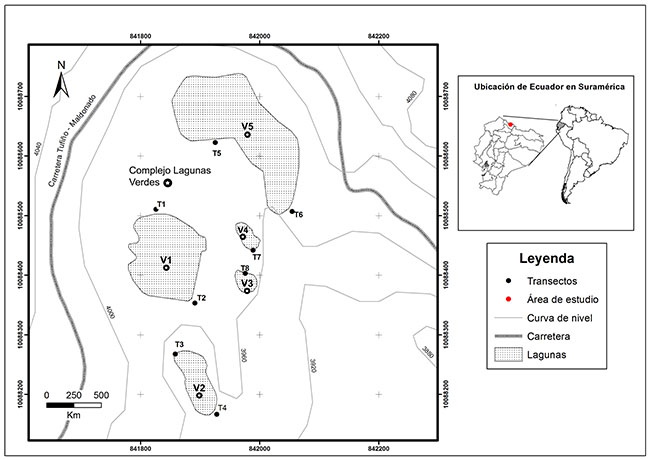
Figura 1. Localización de transectos de vegetación y ubicación geográfica de las lagunas Verdes en la provincia del Carchi, al pie del volcán Chiles, Ecuador.
Las lagunas forman parte de un ecosistema de páramo, se asientan sobre suelos de origen volcánico, con altos contenidos de ceniza y arena volcánica, su pH es ácido y con un alto contenido de materia orgánica, rodeadas de vegetación de pajonal y frailejones (Coello, 1994). La temperatura ambiente oscila entre los 9 y 11 °C pero en días soleados puede subir hasta los 22 °C al medio día. La precipitación es variable y depende de la época del año. Sin embargo, registros históricos señalan un rango de variación entre los 1500 y 3000 mm anuales (INAMHI, 2010).

Figura 2. Laguna Verde 5, ubicada al pie del volcán Chiles, Ecuador. Fotografía: Berenice Vallejo.
Método de muestreo. Para determinar los patrones de cobertura de las especies de plantas acuáticas, utilizamos la técnica de transectos de profundidad en línea, propuesta por Terneus (2001), la cual consiste en demarcar una línea recta superficial, desde la orilla hacia el centro de la laguna, la misma que se subdivide en cuadrantes de vegetación de 1 m2, para tomar los datos del porcentaje de cobertura relativa de cada especie y su frecuencia de aparición en el transecto, y establecer los patrones de dominancia de especies en cada laguna.
Datos fisicoquímicos. Complementariamente, tomamos datos básicos fisicoquímicos de agua (conductividad, pH y temperatura) para correlacionarlos con los patrones de cobertura y dominancia de especies y detectar cambios en las condiciones ambientales, en referencia a la información histórica registrada (Terneus, 2001; Terneus, 2002). Levantamos la información en campo, con un equipo multiparámetros marca Hanna (HI98194).
Análisis de la información. Aplicamos un análisis de conglomerados de Bray & Courtis (1957), para detectar similitudes en los patrones de cobertura de especies, mientras que para los datos abióticos utilizamos un análisis de escalamiento multidimensional (NMDS) en base a distancia euclidiana, como una metodología que mide las distancias de una variable a otra, en función de la disposición de polígonos dentro de una red o cuadrícula. Hicimos una comparación de datos para establecer diferencias entre los patrones abióticos de los ambientes y los patrones de cobertura y dominancia de las especies de plantas acuáticas registradas entre el 2000 y en el 2017. Estos resultados permitieron evidenciar cambios entre los datos históricos (2000) y los actuales (2017) y establecer el probable impacto del cambio climático sobre las comunidades de plantas acuáticas de las Lagunas Verdes, al pie del volcán Chiles.
Resultados
Registramos 15 especies de plantas acuáticas entre tolerantes y estrictas, de las cuales 12 son fanerógamas, 1 pteridofita y 2 hepáticas. La Laguna Verde 2 fue la que presentó mayor riqueza de especies y un porcentaje de cobertura cercano al 100 % de la superficie total de muestreo (Tabla 1).
El porcentaje de frecuencia promedio hace relación a la frecuencia relativa de las especies tanto en cuadrantes, como en transectos y en lagunas. Se observa que Isolepis inundata y Sphagnum sp., son las especies que se presentan con mayor frecuencia en el sistema lagunar, tanto en los registros históricos como en los actuales.
Tabla 1. Registros de los patrones de cobertura y frecuencia de especies de plantas acuáticas observadas en las lagunas Verdes al pie del volcán Chiles, Ecuador.
Observamos la presencia de Agrostis sp., Lachemilla nivalis y Lilaea scilloides, especies helófitas que no se registraron en el año 2000 en las zonas litorales y de ribera y que en la actualidad se encuentran colonizando aquellos espacios anegados que están expuestos a variaciones de los niveles de agua. Por el contrario, especies de hábitos hidrófitos como Juncus stipulatus, Lilaeopsis schaffneriana y una especie de hepática, cuya presencia se registró en el año 2000, actualmente ya no se reportan para las lagunas de estudio.
En definitiva, quedan tan solo siete especies en común entre los dos períodos de estudio, lo que representa aproximadamente una transformación del 40 % de la flora vascular acuática original y una reducción del 17 % de las especies en 17 años (Tabla 1).
Actualmente, las poblaciones potencialmente sensibles a los cambios en la calidad ambiental de las lagunas son Isoetes lechleri y Elatine ecuadoriensis, ya que experimentan una reducción de sus poblaciones en términos de cobertura y frecuencia de aparición superior al 50 % en relación a los registros históricos, e inclusive la única hepática registrada en aquellos tiempos, ahora ya no existe.
Adicionalmente, hay un remanente de especies de rangos tolerantes a los cambios ambientales, como Isolepis inundata, Sphagnum sp. y Ranunculus limoselloides, cuyos cambios estructurales son menores, reflejando altas capacidades de adaptación al cambio climático.
En referencia a los patrones de cobertura de las especies, el análisis de similitud de Bray-Courtis no refleja valores de similitud entre los dos años de muestreo, lo cual corrobora que los patrones de cambio estructurales se mantienen en todas las lagunas analizadas, a excepción de la laguna Verde 5, la cual refleja cierta similitud entre los años 2000 y 2017 (Figura 3).
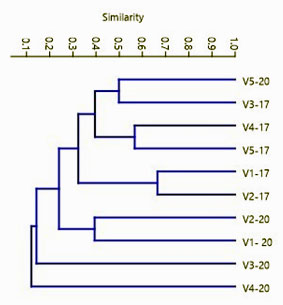
Figura 3. Grado de similitud en los patrones de cobertura de las especies de plantas acuáticas en las lagunas Verdes, volcan de Chiles, Ecuador. La simbología de la figura responde al nombre de la laguna (v= verde) y al año en el que fue realizado el estudio (2017 - 2000).
Las variables abióticas también experimentaron cambios en el transcurso de los últimos 17 años, arrojando variaciones en los valores de pH, conductividad y temperatura del agua (Tabla 2).
Tabla 2. Variables fisicoquímicas del agua registradas durante los años 2000 y 2017 en las lagunas Verdes al pie del Volcán Chiles, Ecuador.
Las lagunas Verde 2 y Verde 5 son las que mayores cambios han experimentado en estos últimos 17 años, al reflejar conductividades menores en la actualidad, que evidencian cambios en la dureza del agua y marcando tendencias del pH hacia la neutralidad. Este fenómeno es particularmente notorio en la laguna Verde 2, que registró un pH de 6.5 en el último muestreo.
El análisis de escalamiento multidimensional (NMDS) en base a distancias euclidianas expresa diferencias en las condiciones ambientales entre las lagunas V1, V3 y V4, durante los registros de los años 2000 y 2017 (Figura 4).
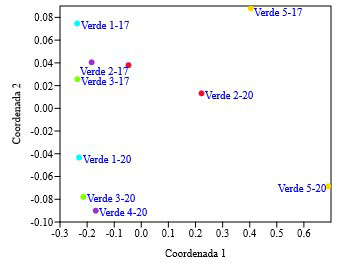
Figura 4. Análisis de escalamiento multidimensional (NMDS) respecto de las variables abióticas de las lagunas Verdes. La simbología de la figura responde al nombre de la laguna y al año en el que fue realizado el estudio (2017, 2000).
Las lagunas V2 y V5 son similares entre sí, respecto de las variables abióticas. Sin embargo, estas difieren del resto de lagunas, mostrando condiciones distintas en los valores de conductividad (Tabla 2). Los resultados del análisis NMDS evidencian además diferencias en las condiciones abióticas entre los dos muestreos (2017 y 2000).
Discusión
Los resultados obtenidos muestran cambios en los patrones de cobertura y dominancia de especies durante los últimos 17 años, posiblemente atribuibles a los impactos del cambio climático en la zona altoandina norte del Ecuador. Las variaciones del pH y la conductividad del agua en las lagunas han restado la condición de dureza a las mismas, propiciando ambientes más neutros que ácidos. Estos cambios han promovido la aparición de tres especies helófitas y la desaparición de tres especies hidrófitas del sistema, marcando indicios de transformación ecológica en las lagunas.
Aunque la influencia volcánica del Chiles podría tener incidencia directa sobre la físicoquímica del agua de las lagunas Verdes, su actividad está catalogada como un volcán potencialmente activo, de baja repercusión, por el momento (IGEPN, 2018), condición que sugiere que no necesariamente la influencia volcánica es la causa principal para el cambio en la estructura y composición florística de las especies de plantas acuáticas de las Lagunas Verdes.
La aparición de especies helófitas en un ecosistema acuático es un indicador de cambio ecológico que marca tendencias hacia la transformación de un ambiente acuático en terrestre, con la consecuente pérdida de diversidad original y la inminente desaparición de las especies hidrófitas, propias de los ambientes acuáticos (Rial et al., 2016). Estos manifiestos se evidencian en los patrones de cobertura y abundancia de las especies, como lo menciona Thomas et al. (2004) a consecuencia de los cambios de temperatura que se están produciendo en la tierra a nivel global.
Por otro lado, los patrones de cobertura y abundancia de las especies de plantas acuáticas también se ven afectados en mayor o menor magnitud por las variaciones de las fluctuaciones de agua en sus zonas riparias (Renöfält at al., 2005; Rial et al., 2016). Este escenario está provocando que especies sensibles como Isoetes lechleri y Elatine ecuadoriensis experimenten reducciones en sus poblaciones, condicionando su permanencia en estas lagunas.
Las fluctuaciones del nivel de agua de las lagunas, han dejado al descubierto, por tiempos prolongados, las zonas litorales de estos cuerpos de agua, afectando las condiciones naturales de los ciclos de vida de las plantas acuáticas (Villaroel et al., 2014). Esta transformación es aprovechada por las especies helófitas, las cuales toleran zonas de anegación, pero que en determinadas épocas del año pueden llegar a secarse por completo, ganando cada vez más el espacio de los litorales lacustres (Salinas et al., 2018).
La desaparición de las especies hidrófitas y la presencia de helófitas no está condicionada únicamente a la presencia del agua y sus nutrientes: hay también otros cambios que se pueden presentar en la composición química del suelo, en cuanto a disponibilidad de nutrientes (Bui, 2013; Maire et al., 2015), por la prolongada exposición al sol en época de estiaje, ocasionando variaciones del pH y conductividad de los ambientes acuáticos por variaciones de salinidad (Nackley & Kim, 2015).
Las variaciones en la temperatura del agua también pueden ocasionar cambios en la concentración de nutrientes usados por las plantas (San Martín et al., 2011), condiciones que son aprovechadas por especies colonizadoras con altos grados de adaptabilidad y tolerancia como Agrostis sp., establecidas en las zonas riparias de los cuerpos de agua del volcán Chiles.
Uno de los métodos más utilizados para determinar cambios en la biodiversidad por el impacto de cambio climático es el uso de modelos matemáticos predictivos de georreferenciación de especies (Franklin, 2009; Hernández et al., 2006). Lastimosamente, estas herramientas informáticas tienen validez siempre y cuando se disponga de información meteorológica histórica de larga data y los resultados sean validados en campo.
Si bien es cierto que la temperatura ambiental y la precipitación son las macrovariables ambientales que demuestran con mayor claridad los impactos del cambio climático sobre la biodiversidad (Tejedor et al., 2015), existen otras variables a escala local y particulares de los ambientes acuáticos que aportan con información importante para detectar cambios en las condiciones abióticas de hábitats específicos. La temperatura del agua, variaciones en el pH y la conductividad, demuestran que sus cambios y variaciones a una escala local son determinantes sobre los patrones de estructura y composición de la flora acuática de las lagunas (Terneus, 2002).
Los altos valores de conductividad de las lagunas Verde 2 y Verde 5, en relación a las demás lagunas, reflejan condiciones distintas en la fisicoquímica del agua, lo que lleva a una diferenciación en su composición florística. Esta diferenciación también podría estar marcada por la relación directa de estas dos lagunas a la actividad volcánica.
Algunas investigaciones señalan además el efecto que puede tener la ubicación altitudinal sobre las especies de alta especificidad de condiciones, poniendo en riesgo su permanencia en estos ambientes (Raxworthy et al., 2008; Sekercioglu et al., 2008) y en particular las limitaciones que presentan las especies acuáticas que crecen en lagunas, en cuanto a mecanismos de dispersión y movilidad, por estar conformando ambientes de aislamiento geográfico (Jetz et al., 2007), como es el caso de las especies mencionadas de crecimiento prostrado hacia el lecho de los cuerpos de agua de las Lagunas Verdes.
Conclusión
Los resultados ponen de manifiesto la gran vulnerabilidad al cambio climático, tanto de los ecosistemas acuáticos como de las especies de plantas que en ellos habitan. También reflejan la capacidad adaptativa de nuevas especies y la sensibilidad de las originales, cuyo umbral de tolerancia a la exposición de condiciones extremas, modifican la estructura de sus poblaciones, iniciando un proceso de transformación ecológica en la zona.
Referencias
Bray, J. R. & Curtis, J. T. (1957). An ordination of the upland forest communities of southern Wisconsin. Ecological Monographs, 27, 325-349.
https://doi.org/10.2307/1942268
Bui, E. (2013). Soil salinity: A neglected factor in plant ecology and biogeography. Journal of Arid Environments, 92, 14-25.
https://doi.org/10.1016/j.jaridenv.2012.12.014
Coello, F. (1994). Plan de manejo de la Reserva Ecológica “El Ángel”, Provincia de El Carchi, Quito. Quito, Ecuador: Convenio MBS- INEFAN – IICA.
Dawson, T., Jackson, S., House, J., Prentice, I. & Mace, G. (2011). Beyond predictions: Biodiversity conservation in a changing climate. Science, 332, 53-58.
https://doi.org/10.1126/science.1200303
Dos Santos Fonseca, A., Marinho, C. & Esteves, F. (2015). Aquatic macrophytes detritus quality and sulfate availability shape the methane production pattern in a dystrophic coastal lagoon. American Journal of Plant Sciences, 6, 1675-1684.
https://doi.org/10.4236/ajps.2015.610167
Fjerdinstad, E., Schtickzelle, N., Manjes, P., Gutierrez, A. & Clobert, J. (2007). Evolution of dispersal and life history strategies. Tetrahymena ciliates. BMC. Evolutionary Biology, 7, 133.
https://doi.org/10.1186/1471-2148-7-133
Foden, W., Butchart, S., Stuart, S. & Akcakaya, H. (2013). Identifying the world´s most climate change vulnerable species: a systematic trait-based assessment of all birds, amphibians and corals. Plos One, 8(06), e65427.
https://doi.org/10.1371/journal.pone.0065427
Franklin, J. (2009). Mapping species distributions: spatial inference and prediction. Cambridge: Cambridge University Press.
https://doi.org/10.1017/CBO9780511810602
Göransson, P. (2017). Changes of benthic fauna in the Kattegat–An indication of climate change at mid-latitudes? Estuarine, Coastal and Shelf Science,194, 276-285.
https://doi.org/10.1016/j.ecss.2017.06.034
Hernández, P., Graham, C., Master, L. & Albert, D. (2006). The effect of sample size and species characteristics on performance of different species distribution modeling methods. Ecography, 29(5), 773–785.
https://doi.org/10.1111/j.0906-7590.2006.04700.x
INAMHI. Instituto Nacional de Meteorología e Hidrología (2010). Anuarios meteorológicos 2010, Quito, Ecuador. Quito: INAMHI.
IGEPN . Instituto Geofísico de la Escuela Politécnica Nacional (2018). Informe especial Volcán Chiles, Cerro Negro, N1-2018. Quito, Ecuador. Quito: IGEPN.
Jetz, W., Wilcove, D. & Dobson, A. (2007). Projected impacts of climate and land-use change on the global diversity of birds. PLOS Biology, 5, 1211–1219.
https://doi.org/10.1371/journal.pbio.0050157
Nackley, L. & Kim, S. (2015). A salt on the bioenergy and biological invasions debate: Salinity tolerance of the invasive biomass feedstock Arundo donax. GCB Bioenergy, 7, 752–762.
https://doi.org/10.1111/gcbb.12184
Jiao, N., Chen, D., Luo, Y., Huang, X., Zhang, R., Zhang, H., Jiang, Z. & Zhang, F. (2015). Climate change and anthropogenic impacts on marine ecosystems and countermeasures in China. Advances in Climate Change Research, 6, 118 -125.
https://doi.org/10.1016/j.accre.2015.09.010
Kwon, Y., Bae, J., Hwang, S., Kim, S. & Park, Y. (2015). Predicting potential impacts of climate change on freshwater fish in Korea. Ecological Informatics, 29, 156-165.
https://doi.org/10.1016/j.ecoinf.2014.10.002
Maire, V., Wright, I., Prentice, I., Batjes, N., Bhaskar, R. & Bodegom, P. (2015). Global effects of soil and climate on leaf photosynthetic traits and rates. Global Ecology Biogeography, 24, 706-717.
https://doi.org/10.1111/geb.12296
Pandit, S., Maitland, B., Pandit, L., Poesch, M. & Enders, E. (2017). Climate change risks, extinction debt, and conservation implications for a threatened freshwater fish: Carmine shiner (Notropis percobromus).Science of the Total Environment, 598, 1-11.
https://doi.org/10.1016/j.scitotenv.2017.03.228
Pounds, J., Fogden, M. & Campbell, J. (1999). Biological response to climate change on a tropical mountain. Nature, 398, 611-615.
Ramsay, P. (2001). The ecology of Volcán Chiles, high altitude ecosystem on the Ecuador-Colombia border. Plymouth, UK: University of Plymouth.
Raxworthy, C., Pearson, R., Rabibisoa, N., Rakotondrazafy, A. & Ramanamanjato, J. (2008). Extinction vulnerability of tropical montane endemism from warming and upslope displacement: a preliminary appraisal for the highest massif in Madagascar. Global Change Biology, 14, 1703-1720.
https://doi.org/10.1111/j.1365-2486.2008.01596.x
Renöfält, B., Nilsson, C. & Jansson, R. (2005). Spatial and temporal patterns of species richness in a riparian landscape. Journal of Biogeography, 32, 2025-2037.
https://doi.org/10.1111/j.1365-2699.2005.01328.x
Rial, A., Terneus, E., Leon, B. & Tognelli, M. (2016). Estado de conservación y distribución de las plantas acuáticas. En Tognelli, M., Lasso, C., Bota-Sierra, C., Jiménez-Segura, L. & Cox, N. (Eds.). Estado de conservación y distribución de la biodiversidade de agua dulce en los Andes tropicales. Gland, Suiza, Cambridge, UK y Arlington, USA: UICN. 199 pp.
Salinas, M., Casas, J., Rubio-Ríos, J., López-Carrique, E., Ramos-Miras J. & Gil, C. (2018). Climate-driven changes of riparian plant functional types in permanent headwater streams. Implications for stream food webs. PLoS ONE, 13(6), e0199898.
https://doi.org/10.1371/journal.pone.0199898
San Martín, C., Pérez, Y., Montenegro, D. & Álvarez, M. (2011). Diversidad, hábito y hábitat de macrófitos en la Patagonia occidental (región de Aisén, Chile). Anales Instituto Patagonia (Chile), 39(1), 23-41.
https://doi.org/10.4067/S0718-686X2011000100002
Sekercioglu, C., Schneider, S., Fay, J. & Loarie, S. (2008). Climate change, elevational range shifts, and bird extinctions. Conservation Biology, 22, 140-150.
https://doi.org/10.1111/j.1523-1739.2007.00852.x
Tejedor, N., Newton, A., Golicher, D. & Oldfield, S. (2015). The relative impact of climate change on the extinction risk of tree species in the montane tropical Andes. PLoS ONE, 10(7), e0131388.
https://doi.org/10.1371/journal.pone.0131388
Terneus, E. (2001). Aquatic plant communities of the páramo lakes of Volcán Chiles, Ecuador. En Ramsay (Ed.) The ecology of Volcán Chiles High altitude ecosystems on the Ecuador – Colombia border. Pp. 55-63. Plymouth: Pebble & Shell.
Terneus, E. (2002). Comunidades de plantas acuáticas en las lagunas de los páramos del norte y sur del Ecuador. Caldasia, 24(02), 379-391.
Thomas, C.D, Cameron, A., Green, R.E., Bakkenes, M., Beaumont, L.J.,Collingham, Y.C., Erasmus, B.F., De Siqueira, M.F., Grainger, A., Hannah, L., Hughes, L., Huntley, B., Van Jaarsveld, A.S., Midgley, G.F., Miles, L., Ortega-Huerta, M.A., Peterson, A.T., Phillips, O.L. Williams, S.E. (2004). Extinction risk from climate change. Nature, 427(6970), 145-8.
https://doi.org/10.1038/nature02121
Urrutia, R. & Vuille, M. (2009). Climate change projections for the tropical Andes using a regional climate model: Temperature and precipitation simulations for the end of the 21st century. Journal of Geography Research, 114(D2), D02108.
https://doi.org/10.1029/2008JD011021
Villarroel, E., Pacheco Mollinedo, P., Domic, A., Capriles, J. & Espinosa, M. (2014). Local management of Andean wetlands in Sajama National Park, Bolivia. Mountain Research and development, 34, 356-368.
https://doi.org/10.1659/MRD-JOURNAL-D-14-00024.1
Williams, S., Luke, P., Joanne, L. & Langham, G. (2008). Towards and integrated framework for assessing the vulnerability of species to climate change. Plos Biology, 6(12), 2621- 2626.
