Recibido: 29 de mayo de 2021; Aceptado: 25 de agosto de 2021
Resumen
Caracterizamos la estructura de la comunidad de mariposas Ithomiini en un remanente de bosque seco tropical del Valle del Cauca, Colombia, donde evaluamos los efectos de las variaciones climáticas sobre la abundancia. Estimamos la estructura de edades de los adultos evaluando el nivel de desgaste alar. Registramos once especies entre marzo y agosto de 2019. Las especies más abundantes fueron Mechanitis menapis, Mechanitis polymnia y Tithorea harmonia que representaron el 85 % de la abundancia relativa; no hubo variaciones significativas en los patrones de abundancia al comparar los resultados con estudios previos. La correlación entre las condiciones climáticas y la abundancia de mariposas fue significativa en ambos casos. Determinamos que el recambio de especies en la comunidad no es afectado por la temporada climática.
Palabras clave:
Abundancia, Mariposas diurnas, Precipitación, Radiación solar, Riqueza..Abstract
We describe the structure of the Ithomiini butterfly community in a tropical dry forest fragment in the Río Cauca Valley, Colombia. We assessed the impact of two climatic seasons on their abundance, and used wing condition to estimate age structure. We recorded 11 species in six months (March to August, 2019). The most abundant species were Mechanitis menapis, Mechanitis polymnia and Tithorea harmonia, accounting for 85 % of the relative abundance; there were no significant changes in abundance patterns, when compared with previous studies. In both cases, the correlation between climate factors and butterfly abundance is significant. Species turnover was not affected by climatic season.
Keywords:
Abundance, Daytime butterflies, Precipitation, Richness, Solar radiation..Introducción
El bosque seco tropical (bs-T) es uno de los ecosistemas más amenazados y menos estudiados de Colombia (Pizano & García, 2014; González et al., 2018; Kattan et al., 2019; Henao-Bañol & Gantiva-Q., 2020). Se caracteriza por un alto grado de endemismo, temperaturas superiores a 17 °C y una estacionalidad fuertemente marcada, que abarca de cuatro a seis meses de sequía y determina su fenología distintiva (Murphy & Lugo, 1986; Dirzo et al., 2011). En Colombia, este ecosistema se encuentra en los valles interandinos de los ríos Magdalena y Cauca, y las regiones de la llanura Caribe (Linares & Fandiño, 2009). La deforestación, como resultado de diferentes actividades humanas, ha sido reconocida como su principal amenaza (Orozco et al., 2009; Gaviria-Ortiz & Henao-Bañol, 2011; Casas-Pinilla et al., 2017).
En el Valle del Cauca, la actividad agropecuaria extensiva ha generado la mayor pérdida de hábitat y fragmentación del bs-T debido a que estos bosques se asientan principalmente sobre suelos fértiles que benefician estas actividades productivas (Álvarez et al., 1998). El paisaje del bs-T en el departamento se caracteriza por una configuración de fragmentos aislados por una matriz principalmente agrícola (Pizano & García, 2014). El Parque Regional El Vínculo es uno de estos remanentes. Rodeado de una matriz de caña de azúcar y pastizales, este fragmento de 70 ha de bosque está compuesto por diferentes estados sucesionales, dónde hay áreas de regeneración, relicto de bosque primario intervenido, bosque secundario y matorral (Arenas & Giraldo, 2013).
En paisajes con alto nivel de pérdida de hábitat, que además corresponden a hábitat amenazados y poco estudiados, como el bs-T (Dirzo et al., 2011), entender el estado de su biodiversidad es esencial para desarrollar mejores estrategias de conservación. Las mariposas diurnas son un buen modelo de estudio, ya que aportan información acerca de la diversidad de un ecosistema y su estado de conservación (DeVries et al., 1999). Por otra parte, este grupo de organismos presenta ventajas como facilidad para el muestreo, un ciclo de vida corto y conocido, y sensibilidad a los cambios en el microclima, temperatura, humedad y radiación solar y la disponibilidad de recursos, los cuales son parámetros que cambian por las perturbaciones en los ecosistemas naturales (Montero et al., 2009; Muriel & Kattan, 2009; Orozco et al., 2009; Bonebrake et al., 2010; Gaviria-Ortiz & Henao-Bañol, 2011).
Dentro de las mariposas diurnas (Lepidoptera: Papilionoidea), las especies pertenecientes a la tribu Ithomiini son particularmente interesantes, por presentar una fuerte correlación positiva entre su riqueza y el total de especies de mariposas presentes en un área de estudio (Beccaloni & Gaston, 1995). Estas especies son exclusivas de los bosques Neotropicales (García et al., 2002; Valencia et al., 2005; Muriel & Kattan, 2009; Casas-Pinilla et al., 2017) y sus larvas utilizan principalmente plantas de la familia Solanaceae para alimentarse (García et al., 2002; Valencia et al., 2005; Muriel & Kattan, 2009). Los adultos suelen dividirse a través de la estratificación del bosque, dependiendo de los patrones y coloración de las alas (Beccaloni, 1997). Las especies con alas transparentes (alas de cristal) tienden a volar más cerca del sotobosque, mientras que las especies con patrones de coloración atigrada vuelan en rangos más amplios de la estructura vertical del bosque (Burd, 1994; Beccaloni, 1997), lo que demuestra su mayor tolerancia a diferentes condiciones ambientales (Muriel & Kattan, 2009). En este estudio estimamos la diversidad de mariposas Ithomiini en un área protegida de carácter regional en el Valle del Cauca. Comparamos los resultados obtenidos con los de un estudio previo y evaluamos el efecto de las dos temporadas climáticas que caracterizan a estos bosques, sobre la riqueza y estructura de edades de los estados adultos.
Materiales y métodos
Área de estudio
El Parque Natural Regional El Vínculo se encuentra ubicado en el centro del valle geográfico del río Cauca, corregimiento El Vínculo, municipio Guadalajara de Buga, departamento Valle del Cauca (Figura 1). La reserva se encuentra sobre el piedemonte de la cordillera Central (3° 50’ 43.3’’ N, 76° 18’ 08’’ O). Su altitud está entre 977 y 1150 m (Arenas & Giraldo, 2013). Es uno de los remanentes de bs-T más grandes y conservados en esta zona, con un total de 70 ha. Hace parte del 5 % de los ecosistemas de bs-T representados en el Sistema Nacional de Áreas Protegidas (SINAP) (Torres et al., 2012). La precipitación anual oscila entre 1200 y 1800 mm, con un régimen de precipitación bimodal que corresponde a dos trimestres de época seca (diciembre-febrero y junio- agosto), y dos de época lluviosa (marzo-mayo y septiembre- noviembre) (Gaviria-Ortiz & Henao-Bañol, 2011). La temperatura promedio es de 25 °C. El muestreo abarcó las dos temporadas climáticas del año 2019: la estación lluviosa (marzo-mayo) y la estación seca (junio-agosto).
Figura 1: Parque Natural Regional El Vínculo, Buga, Valle del Cauca, Colombia.
Zonas de muestreo
A partir de un recorrido previo para la identificación de áreas con mayor presencia de mariposas Ithomiini, seleccionamos tres zonas del parque para realizar nuestro muestreo. Se eligieron tres senderos con representación de los diferentes tipos de cobertura y uso presentes en el parque; dos (sendero 1 y 3) son utilizados como caminos turísticos y presentan cobertura vegetal de bosque primario intervenido (Arenas & Giraldo, 2013); el sendero 3 comprende bosque ribereño por la presencia de una quebrada aledaña. Por último, el sendero 2 se ubicó en la zona intangible de la reserva que corresponde al área destinada para la restauración natural del bosque, y adonde no se permite el ingreso de visitantes.
Diseño de muestreo
Se realizaron 20 salidas de campo entre el 11 de marzo y el 18 de agosto de 2019, durante las cuales se recorrieron los tres senderos entre las 9:00 y las 14:00, por ser el horario de mayor actividad de las mariposas. Se utilizó observación directa, y se capturaron los individuos con una red entomológica (Villareal et al. 2004). Cada uno de los senderos utilizados se marcó cada 10 metros para tener referencia del transecto donde se capturaban las mariposas Para el sendero número uno, se marcaron 36 transectos, para el número dos se marcaron 24 y para el sendero número cuatro se marcaron 21; por lo tanto, la longitud de los senderos fue de 360, 240 y 210 metros respectivamente. Con el objetivo de individualizar cada una de las mariposas y tratar de establecer el tamaño poblacional, se les asignó un número consecutivo en las alas anteriores con un marcador de tinta indeleble. Después de marcadas, cada mariposa fue fotografiada y liberada. Este trabajo fue realizado por dos personas, una realizando las capturas con red entomológica y la otra persona tomando nota de capturas y marcando los individuos. Finalmente, siguiendo a Freitas (1993) y Prieto (2005) a cada individuo se le estimó la edad teniendo en cuenta el desgaste alar, y establecimos tres categorías de edades, juveniles o recién emergidos, mariposas con alas completas y ninguna pérdida de escamas; intermedios, mariposas con características intermedias entre jóvenes y viejos, y viejos, mariposas con alas opacas y pérdida severa de escamas .
Datos ambientales
Para establecer si hubo efectos de las temporadas climáticas sobre la diversidad de mariposas, obtuvimos los datos de precipitación promedio mensual y radiación solar para cada día de muestreo de la estación meteorológica Buga Centro-Norte, de Cenicaña. Esta estación es la más cercana a la reserva (03° 58’ 11.99” N, 76° 17’ 14.31” O), y permite obtener registros diarios.
Análisis de la información
Determinamos la eficiencia del muestreo mediante curvas de acumulación de especies, utilizando el programa EstimateS 9.1(Colwell, 2016), con una aleatorización de 100 interacciones, para crear curvas suavizadas (Colwell & Coddington, 1994; Moreno & Halffter, 2000). Tuvimos en cuenta los estimadores Chao 1 y ACE que permiten estimar la diversidad esperada (Moreno, 2001). Mediante una prueba t Student establecimos si las abundancias de las especies de mariposas variaron a través de los años, comparando nuestros resultados con las abundancias estandarizadas reportadas para el año 2008 por Gaviria-Ortiz & Henao-Bañol (2011).
Para determinar si la temporada climática tuvo efecto sobre la abundancia de mariposas, evaluamos la similitud en el número de individuos por especie entre las dos temporadas, mediante una prueba pareada de Wilcoxon. Establecimos si las proporciones de edades de los individuos adultos fueron iguales dentro de la población, mediante una prueba de Chi2 para cada especie, teniendo en cuenta la categoría de edad. Así mismo, realizamos un ANOVA de dos vías para establecer si la proporción de individuos juveniles difería entre temporadas. Finalmente, hicimos correlaciones para establecer si la precipitación y la radiación solar tuvieron efectos sobre la riqueza de especies. Todos los análisis estadísticos fueron realizados en el programa PAST 3.26 (Hammer et al., 2001).
Resultados
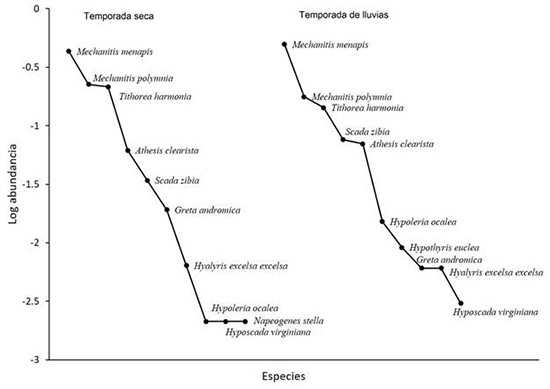
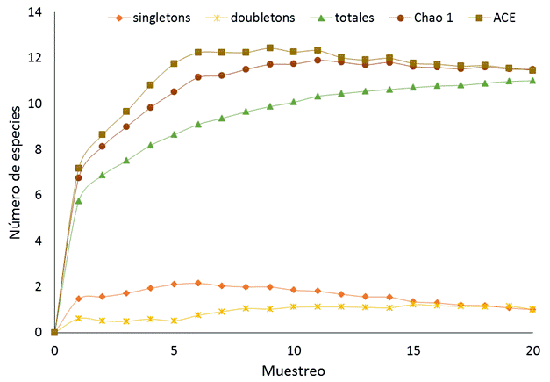
En un esfuerzo total de 100 horas de muestreo se marcaron 799 individuos de la tribu Ithomiini, pertenecientes a 11 especies. En cada temporada se registraron 10 especies; sin embargo, el número de individuos registrados durante la temporada seca fue mayor que en la temporada lluviosa; en la época seca, Hypothyris euclea no fue registrada, mientras que Napeogenes stella estuvo ausente en la época de lluvia. De todas las especies registradas, Mechantis menapis fue la más abundante y representó el 45.80 % del total de la muestra; la siguen en abundancia M. polymnia y Tithorea harmonia (Figura 2). La curva de acumulación de especies para nuestro muestreo mostró una asíntota para el número de especies capturadas. Los estimadores no paramétricos calculados Chao 1 y ACE indican que el esfuerzo de muestreo logró una estimación superior al 95 % de la diversidad de itóminos del parque (Figura 3). La comparación de las abundancias relativas entre el muestreo de Gaviria-Ortiz & Henao-Bañol (2011) y nuestro muestreo, no mostró diferencias significativas (t = -1.738, P>0.05). Pese a algunas excepciones, las especies más abundantes en nuestro estudio corresponden a las mismas reportadas en el año 2008 (Anexo 1).
Figura 2: Abundancia relativa de especies de mariposas Ithomiini por temporada climática, en el Parque Natural Regional El Vínculo, Buga, Colombia.
Figura 3: Curva de acumulación de especies de mariposas Ithomiini en el Parque Natural Regional El Vínculo, Buga Colombia. Observadas y esperadas, según estimadores no paramétricos (Chao 1 y ACE).
Estructura de edades
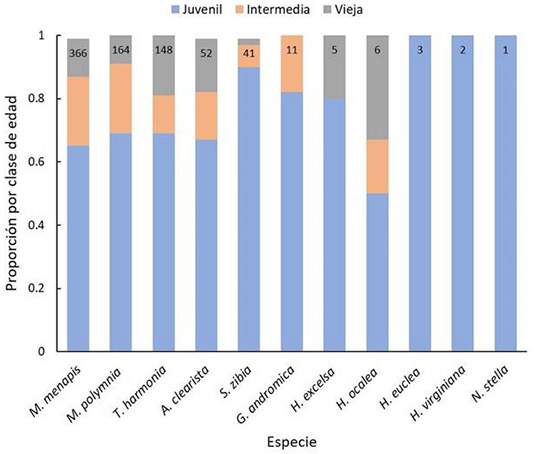
Los adultos jóvenes recién emergidos representaron el 68.58 % de la muestra, seguidos por los de edad media con un 18.77 %.A nivel de especie, solo 3 de las 11 especies registradas mostraron proporciones similares para los tres tipos de desgaste alar: Hyalyris excelsa (x 2 =5.2; P>0.05), Hypoleria ocalea (x 2 =1; P>0.05) e Hypothyris euclea (x 2 =6; P>0.05). Para las especies M. menapis (x 2 =173.92; P<0.01), M. polymnia (x 2 =97.40; P<0.01), Tithorea harmonia (x 2 =85.35; P<0.01), Athesis clearista (x 2 =27.038; P<0.01), Scada zibia (x 2=59.90; P<0.01) y Greta andromica (x 2 =12.18; P<0.05) la proporción de representación de cada desgaste alar fue diferente, con mayor representación de juveniles (Figura 4). De igual manera, la ANOVA de dos vías no mostró diferencias significativas en la proporción de individuos juveniles entre temporadas (F 1,10 =0.57; P>0.05), ni entre especies (F 10,10 =0.33; P>0.05).
Figura 4: Proporción de individuos por clase de edad para las especies de mariposas Ithomiini en el Parque Natural Regional El Vínculo, Buga, Colombia. En la parte superior de las barras se observa el número de individuos capturados por especie.
Variables climáticas y diversidad
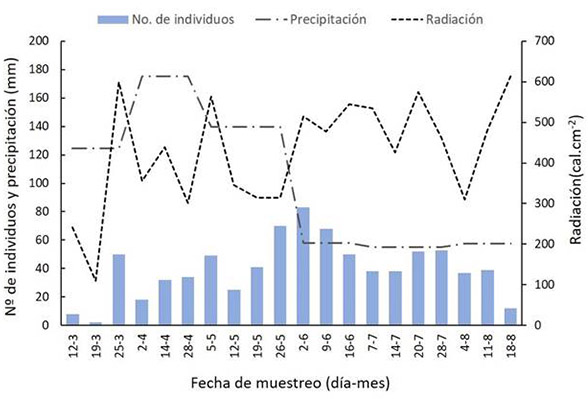
La época de lluvia (marzo-mayo) tuvo la menor cantidad de capturas, con 329 individuos; el mínimo de capturas fue dos individuos en el segundo muestreo (marzo 19 de 2019), y el máximo 70 individuos en el muestreo 10 (mayo 26 de 2019). En la época seca, el total de capturas fue de 470 individuos, con un mínimo de 12 individuos en el muestreo 20 (agosto 18 de 2019) y un máximo de capturas de 83 individuos en el muestreo 11 (junio 2 de 2019). Sin embargo, la prueba pareada de Wilcoxon indica que no existieron diferencias estadísticamente significativas en la abundancia de especies entre las dos temporadas climáticas (W = 41; P >0.05) (Figura 5).
Figura 5: Número de individuos de mariposas Ithomiini por fecha de captura (día-mes), para las dos temporadas climáticas, y su respectiva precipitación mensual promedio (mm) y radiación diaria (cal.cm-2), en el Parque Natural Regional El Vínculo, Buga, Colombia. Temporada de lluvias: marzo, abril y mayo. Temporada seca: junio, julio y agosto.
Se encontró una correlación positiva y significativa entre la radiación solar y la abundancia de las mariposas (R = 0.21; P<0.05). En contraste, la relación entre abundancia y precipitación fue negativa y marginalmente significativa (R= -0.41; P=0.06); la precipitación durante la temporada de muestreo fue baja.
Discusión
En este estudio reportamos 11 especies de mariposas pertenecientes a la tribu Ithomiini, mientras que Gaviria-Ortiz & Henao-Bañol (2011), registraron para la misma localidad, un total de 28 especies de esta misma tribu en 2008. En nuestro caso, la mayoría de las especies registradas correspondieron a las denominadas ‘atigradas’ que presentan amplia distribución y abundancia; los registros de especies con ‘alas de cristal’ fueron escasos, lo cual es esperable, teniendo en cuenta que son naturalmente especies menos abundantes y de distribución muy restringida (Ramírez et al., 2007; Muriel & Kattan, 2009). Pese a la escases de mariposas de ‘alas de cristal’ en nuestro estudio no encontramos diferencias significativas entre las abundancias relativas de las especies para los dos años de estudio, lo que podría sugerir un efecto de la detectabilidad de las distintas especies (Anexo 1). Es importante destacar el hecho de que en los últimos 10 años no se hayan registrado cambios sustanciales en la comunidad de mariposas Ithomiini del Parque Regional el Vínculo, ya que esto podría indicar qué funciones ecosistémicas como la polinización y herbívora, asociadas a este grupo, se estarían conservando localmente, ya que por lo general estas dependen de las especies más abundantes (McGill et al., 2006). Por otra parte, en términos de riqueza, aunque si hay un cambio sustancial (de 21 a 17 especies), la mayoría de especies que hacen la diferencia entre los dos años de muestreo, son especies raras, con abundancias muy bajas (un individuo), con excepción de G. andromica, la cual se registró 11 veces durante el 2018, mientras que solo se encontró dos veces en el año 2008 (Anexo 1). Estos cambios en la riqueza pueden estar explicados por la diferencia en la intensidad de muestreo, como en las épocas en las que estos se hicieron.
A pesar de no haber encontrado diferencias significativas en la abundancia de las especies de Ithomiini entre Gaviria-Ortiz & Henao-Bañol (2011) y nuestra investigación, hubo diferencias en la abundancia de algunas especies. La especie más abundante en ese estudio fue T. harmonia, la tercera en abundancia en el nuestro; esta especie sólo ha sido reportada como la más abundante de esa tribu en bosque seco en este estudio; esta diferencia en abundancia podría estar dada por cambios en la disponibilidad de enredaderas de la familia Apocynaceae, que son las planta hospederas para especies basales de Ithomiini, como es el género Tithorea (Freitas et al., 2001). Sin embargo, en ninguno de los estudios se evaluó la oferta de recursos alimenticios para las larvas, por lo cual esto es especulativo. La segunda especie más abundante en 2008 fue M. polymnia. En nuestro estudio, la especie más abundante fue M. menapis, seguida de M. polymnia, resultado que coincide con el estudio de Orozco et al. (2009) en un fragmento de bs-T de San Jerónimo, Antioquia. Las especies del género Mechanitis se encuentra principalmente en ecosistemas medianamente intervenidos, mientras que especies de otros géneros de la tribu han sido relacionadas con ecosistemas en mejor estado de conservación (Orozco et al., 2009). Al hacer estas comparaciones entre años, es necesario tener en cuenta que las poblaciones pueden variar por factores como la oferta de recursos y el clima, entre otros (Freitas et al., 2001). Sin embargo, al no detectar diferencias estadísticamente significativas, consideramos que estos cambios pueden deberse a un efecto de muestreo, sobre todo porque la mayoría de las especies tienen una detectabilidad imperfecta que puede deberse a múltiples factores no considerados en ninguno de los dos estudios (MacKenzie et al., 2017).
Por otra parte, la escasez de las especies de “alas de cristal” en nuestro muestreo podría estar relacionada con la disponibilidad de plantas hospederas para las larvas y el recurso de néctar para los adultos, así como con la presencia de ambientes húmedos y sombreados dentro de los bosques (Muriel & Kattan, 2009). De acuerdo con Ramírez et al. (2007), la tribu Ithomiini presenta una disminución en su riqueza específica en lugares con pocas fuentes de agua, posiblemente por su sensibilidad a las altas temperaturas, baja humedad relativa y alta exposición solar (Pinheiro et al., 2008). Sin embargo, los datos recolectados hasta la fecha no nos permiten discriminar entre esta hipótesis y la de detectabilidad, que tampoco son excluyentes. Por esta razón, recomendamos, a partir de los datos aquí presentados, establecer un plan de monitoreo que permita determinar si las especies no registradas en nuestro estudio son producto de su rareza o por cambios en la disponibilidad de recursos y de hábitat.
Pese a que todas las mariposas capturadas fueron marcadas, las recapturas fueron muy bajas, impidiendo estimar los tamaños poblacionales. En general, las poblaciones de Ithomiini se consideran difíciles de estudiar debido a la baja recaptura de adultos, aun en lugares de alta densidad (Freitas et al., 2001). Teniendo en cuenta que de las especies más comunes se capturaron más de 50 individuos (Anexo 1), puede inferirse que las poblaciones que hacen parte de la comunidad de mariposas Ithomiini en esta localidad son muy dinámicas, como lo sugieren Muriel & Kattan (2009). Los individuos jóvenes obtuvieron la mayor representación dentro de la comunidad, coincidiendo con lo reportado por Muriel & Kattan (2009) en fragmentos de bosque nublado. En ambos casos se puede observar un alto reclutamiento de individuos jóvenes durante todo el muestreo, independiente de la temporada climática, sugiriendo una constante reproducción local o inmigración desde fragmentos aledaños, lo que podría garantizar una comunidad estable a corto plazo. Este patrón también fue reportado por Freitas (1993) en bosque lluvioso montano secundario, con predominancia de plantas de borde en Brasil, presentando una dominancia de individuos recién emergidos, con algunas variaciones que podrían sugerir periodos de eclosión.
Una de las principales características del bs-T es su marcada estacionalidad, por lo que la intensidad en la radiación solar y precipitación pueden ser variables determinantes en la actividad de distintos grupos, incluidas las mariposas. Moyers-Arévalo & Cano-Santana (2009) mencionan a la lluvia como una de las principales causas del daño y muerte de los individuos, teniendo efectos sobre la abundancia de una comunidad de mariposas, resultado que coincide con nuestros hallazgos, en el cual registramos una menor abundancia en la época lluviosa con respecto a la época seca, aunque a nivel comunitario la diferencia no sea estadísticamente significativa. Sin embargo, tanto el patrón de diversidad como el reclutamiento de individuos juveniles se mantiene para las dos estaciones. Este patrón podría estar relacionado con la constante disponibilidad del recurso florístico, cómo lo proponen Tobar-L. et al. (2002) quienes encontraron para la tribu Ithomiini un incremento en la riqueza de especies para la época seca, pero una abundancia constante en ambas temporadas climáticas.
Las mariposas diurnas requieren de la radiación solar para acumular calor, aumentar su temperatura corporal y obtener la energía necesaria para cumplir con sus funciones vitales (Heinrich, 1986; Bryant et al., 2002; Abrahamczyk et al., 2011). Por este motivo, los periodos de nubosidad podrían afectar negativamente a las mariposas, afectando algunas funciones, como el vuelo (Kingsolver, 1983; Moyers-Arévalo & Cano-Santana, 2009). En nuestra investigación, la radiación solar fue significativa para la abundancia de Ithomiini y se observó un incremento en el número de individuos capturados en días de mayor radiación. Este resultado puede tener relación con la conformación de agregaciones de Ithomiini en cercanía a cuerpos de agua y áreas más sombreadas durante la época seca, que se disuelven en periodos de mayor precipitación (Brown & Freitas, 2002; Ramírez et al., 2007; Pinheiro et al., 2008, Boom-Urueta et al., 2013).
En conclusión, nuestros resultados resaltan la importancia de mantener y proteger fragmentos de bosque seco para la conservación de las mariposas de la tribu Ithomiini. Aunque nuestro estudio involucró principalmente a las especies más comunes, estas son indicadores de un buen estado del ecosistema y su biodiversidad. El hecho de que se hayan registrado 799 individuos con pocas recapturas, y un número considerable de juveniles durante todos los meses de muestreo, independientemente de la época climática, sugiere que las poblaciones de mariposas presentes en el Parque Regional El Vínculo se encuentran en buen estado y podrían estar manteniendo los procesos ecosistémicos a los que se vinculan. Sin embargo, como mencionamos anteriormente, consideramos necesario el diseño e implementación de un plan de monitoreo enfocado en estas especies, que permita detectar cambios en el tiempo y sus causas más probables.