Recibido: 30 de mayo de 2020; Aceptado: 9 de noviembre de 2020
Resumen
Registramos el paisaje sonoro en cuatro fincas ganaderas en el piedemonte llanero del departamento del Meta, Colombia. Se utilizaron ocho grabadoras acústicas, cuatro en silvopastoriles de potreros arbolados y cuatro en sistemas de ganadería tradicional. Cada grabadora estuvo grabando 1 minuto cada 10 minutos, durante un promedio de 4 días, en noviembre de 2019. Se obtuvieron 4743 grabaciones de un minuto, 57.3% para sistemas de potreros tradicionales y 42.7% para potreros arbolados. Se encontraron diferencias en la actividad acústica y el uso del espacio acústico, el cual está relacionado a la distancia a las quebradas. Las variables distancia a vías y a quebradas explicaron la variación de riqueza de aves y anuros, la cual fue menor para potreros arbolados en relación a los potreros tradicionales, lo que puede estar relacionado con el diseño del sistema silvopatoril (monocultivo de falso yopo, Mimosa trianae). Futuras iniciativas silvopastoriles deberían incluir diseños más diversos para poder contrastar el tipo de métricas evaluadas en este estudio.
Palabras clave:
Anuros, Aves, Colombia, Detecciones, Espacio acústico, Huella acústica, Orinoquia..Abstract
We recorded the soundscape at four cattle ranches at the foothills of the Meta department, Colombia. We used eight acoustic recorders, four in silvopastoral systems and four in traditional cattle systems. Each recorder operated for 1 minute every 10 minutes, for an average of 4 days, in November 2019. We obtained 4743 one-minute recordings, 57.3% for traditional cattle systems and 42.7% for silvopastoral systems. Differences were found in the acoustic activity and use of the acoustic space, which are related to the distance to the streams. The variables distance to roads and streams explain the variation in richness of bird and anuran, which was lower in silvopastoral systems than traditional cattle systems. This may be related to the design of the silvopatoral system (Mimosa trianae monoculture). Future silvopastoral initiatives should include more diverse designs in order to contrast the type of metrics evaluated in this study.
Key words:
Acoustic space, Acoustic print, Anurans, Birds, Orinoco..Introducción
La ecología del paisaje sonoro es una ciencia emergente que permite tener una aproximación a la dinámica de los paisajes (Campos-Cerqueira & Aide, 2017; Tucker et al., 2014) y ha venido desarrollando nuevas herramientas para su estudio (Depraetere et al., 2012; Pekin et al., 2012; Pijanowski et al., 2011; Sueur et al., 2008). Particularmente, la ecología de los paisajes sonoros usa el sonido para investigar los procesos que afectan la diversidad biológica de un ecosistema y recopilar información sobre la composición, estructura y actividad acústica de la fauna, y cómo se relaciona esto con ciertas variables de paisaje (Campos-Cerqueira & Aide, 2017; Joo et al., 2011; Rodríguez-Buriticá et al., 2018; Tucker et al., 2014). El monitoreo acústico automatizado se ha vuelto más popular y asequible desde la aparición de equipos de grabación portátiles y de bajo costo (Gibb et al., 2019), los cuales permiten cuantificar la biodiversidad a través de la actividad vocal de una comunidad en un ecosistema y evidenciar cambios a través del espacio y el tiempo (Depraetere et al., 2012). Además, este método automatizado ha sido implementado en el estudio de ciertos grupos taxonómicos, entre los que se destacan los insectos (Manakin et al., 2011), anuros (Ospina et al., 2013), mamíferos (Kalan et al., 2015), aves (Campos-Cerqueira & Aide, 2016), o a escala de comunidades (Aide et al., 2017).
Recientemente se estableció la Red de Ecoacústica Colombiana, que generó el primer reporte de paisajes sonoros para Colombia, con 330 áreas de estudio de monitoreo acústico pasivo. Estas áreas incluyen ecosistemas naturales poco perturbados y transformados (Rodríguez-Buriticá et al., 2018). Sin embargo, para la Orinoquia colombiana no existen estudios de este tipo que permitan describir la biodiversidad desde una dimensión acústica (Rodríguez-Buriticá et al., 2018). En esta región, los procesos de ganadería extensiva y el desarrollo agroindustrial han generado cambios en los usos del suelo (Romero-Ruiz et al., 2012), lo cual se ha acelerado en el nuevo escenario de postacuerdo, sumado a la alta presión de desarrollo agroindustrial (Williams et al., 2020). Esta transformación es evidente especialmente en el departamento del Meta, donde la tasa de deforestación en 2018 fue una de las más altas en el país, principalmente asociada a actividades agrícolas a gran escala, como ganadería extensiva y cultivos ilícitos (IDEAM, 2019). Bajo este desalentador escenario, una de las estrategias de conservación que se ha venido impulsando a través del proyecto Ganadería Colombiana Sostenible es la implementación de sistemas silvopastoriles como sistemas productivos que promueven la diversidad biológica en zonas ganaderas y agrícolas homogéneas (Murgueitio et al., 2013), al generar pequeñas manchas aisladas de vegetación y corredores de hábitat heterogéneos (Naranjo, 1992).
Los sistemas silvopastoriles son un escenario interesante para estudiar cómo la heterogeneidad espacial influye en la estructura y el funcionamiento de los ecosistemas (Wu, 2004). Esta heterogeneidad generada por los sistemas silvopastoriles puede verse reflejada en variaciones de composición del paisaje acústico (Bormpoudakis et al., 2013). A pesar de que son pocos los estudios de biodiversidad en sistemas silvopastoriles en Colombia, se han encontrado diferencias en la composición y estructura de las comunidades de aves entre sistemas silvopastoriles y sistemas productivos no silvopastoriles (Fajardo et al., 2009). Teniendo en cuenta que las comunidades de aves pueden ser diferentes y que las comunicaciones acústicas de los animales se reflejan directamente en el paisaje sonoro (Aide et al., 2017), esperamos encontrar diferencias entre los paisajes sonoros de sistemas silvopastoriles y los sistemas de ganadería tradicional.
Con base en lo anterior, el objetivo general de este estudio fue evaluar si existen diferencias entre el uso del espacio acústico en sistemas silvopastoriles y sistemas ganaderos tradicionales en el piedemonte llanero de la Orinoquia colombiana. En particular, analizamos los componentes del paisaje sonoro, a través de detecciones de dos grupos indicadores y mejor conocidos en su acústica (aves y anuros) y diferencias entre el número de especies acústicamente activas en estos sistemas productivos.
Materiales y métodos
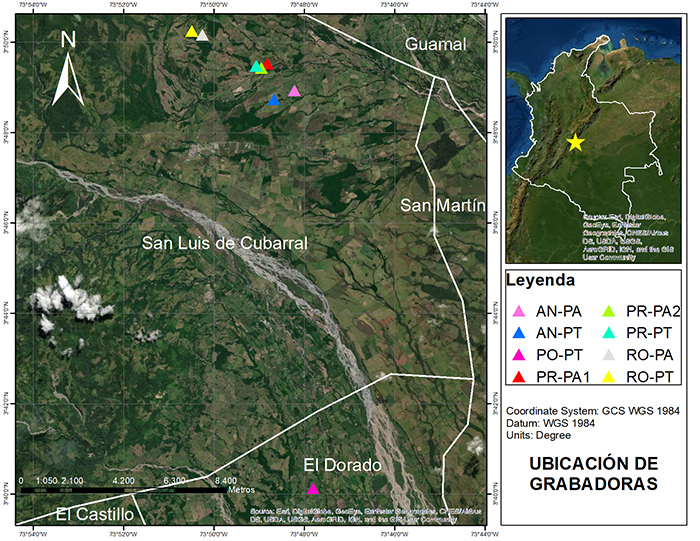
Área de estudio. El trabajo se desarrolló en el piedemonte llanero de la Orinoquia colombiana en el departamento del Meta (Figura 1). El muestreo se realizó en cuatro fincas que hacen parte del proyecto Ganadería Colombiana Sostenible (http://ganaderiacolombianasostenible.co), con elevaciones entre 424 y 738 m s.n.m: El Porvenir, con 37 ha y 70-80 cabezas de ganado (Dorado); La Rosania, con 79 ha y 150 cabezas de ganado; la finca Andorra, con 257 ha y 421 cabezas de ganado; y finca La Pradera con 217 ha y 316 cabezas de ganado (San Luis Cubarral; Tabla 1). La zona de piedemonte del Meta tiene una humedad que oscila entre el 47% y el 75%, temperatura promedio de 26 ° C y una precipitación anual unimodal de 4500 mm, con una temporada de lluvias de abril a noviembre (IDEAM, 2005). Los sistemas de ganadería tradicional usan potreros tradicionales sin árboles y dominados por pastos exóticos, como Brachiaria spp. Aunque existen diferentes sistemas silvopastoriles en el piedemonte, en este estudio se incluyeron solo potreros con árboles dispersos o potreros arbolados con falso yopo (Mimosa trianae), una especie arbórea nativa con un dosel poco denso que permite la filtración de la luz; además, sus foliolos pequeños se descomponen rápidamente, retienen agua y son claves en la fijación de nitrógeno (Calle et al., 2012). Los árboles en los potreros tenían entre 6 y 12 años al momento del estudio. La finca El Porvenir era la única donde los potreros tradicionales estaban junto a una plantación de Theobroma cacao de 6 a 8 años. Los bosques nativos dentro de las fincas estaban asociados a cursos de agua, y se caracterizaban por tener árboles de 12-25 m. Adicionalmente, todas las fincas utilizan cercas vivas para dividir potreros o predios.
Figura 1: Ubicación de las fincas donde se muestrearon los paisajes sonoros en el departamento del Meta, Colombia. AN, Andorra; PO, El Porvenir; PR La Pradera; RO, La Rosanía; PA, potreros arbolados (sistemas silvopastoriles); PT potreros tradicionales.
Tabla 1: Características de los sitios donde se muestrearon los paisajes sonoros en el departamento del Meta, Colombia. PA, potreros arbolados (sistemas silvopastoriles); PT, potreros tradicionales.
Finca
Sistema
Nombre sitio
Latitud
Longitud
Elevación (m)
Grabaciones
Días
Porvenir
PT
PT_Porvenir
3°40´07.39” N
73°22´46.83” O
424
719
4.99
Andorra
PT
PT_Andorra
3°48´44.50” N
73°48´41.04” O
534
727
5.05
Pradera
PT
PT_Pradera
3°49´28.78” N
73°49´04.04” O
560
541
3.76
Rosania
PT
PT_Rosania
3°50´15.04” N
73°50´29.29” O
770
730
5.07
Andorra
PA
PA_Andorra
3°48´56.23” N
73°48´13.07” O
520
728
5.06
Pradera
PA
PA_1Pradera
3°49´31.66” N
73°48´49.36” O
525
437
3.03
Pradera
PA
PA_2Pradera
3°49´26.00” N
73°48´56.74” O
525
142
0.99
Rosania
PA
PA_Rosania
3°50´09.74” N
73°50´15.11” O
738
729
5.06
Toma de datos. Entre el 9 y el 27 de noviembre de 2019 se instalaron grabadoras en sistemas silvopastoriles de árboles dispersos de falso yopo (M. trianae) y en sistemas de ganadería tradicional. Usamos sistemas de grabación pasiva ARBIMON de Sieve Analytics, por medio de la aplicación ARBIMON Touch para Android, instalada en teléfonos celulares marca Motorola MotoG1, los cuales se instalaron dentro de una caja plástica (Grace Digital Eco Pod) que protegía el dispositivo de la lluvia. Cada celular se conectó a un micrófono (Monoprice) que permitía ampliar el rango de grabación de los teléfonos celulares (Herrera-Montes, 2018). Los teléfonos se programaron con la aplicación para grabar a una frecuencia de 44.1 kHz con 16 bits de resolución durante 1 minuto, a intervalos de 10 minutos por un promedio de 4 días en cada lugar (Tabla 1), generando grabaciones con formato no comprimido WAV. Las grabadoras se instalaron manteniendo una distancia mínima de 200 metros, a una altura de 1.50 metros del suelo y aseguradas con cuerdas a un tronco de árbol, con el micrófono dirigido hacia abajo (Herrera-Montes, 2018).
Covariables ambientales. Para evaluar el efecto en el paisaje sonoro, se definieron covariables ambientales a partir de la imágen del satélite Sentinel-2 del 25 de diciembre de 2018 (Dymond et al., 2002; Samarawickrama et al., 2017), que permite una resolución entre 10 y 20 m (Vrieling et al., 2018). Se calculó el porcentaje de bosque natural (incluso secundario), potrero arbolado y potrero tradicional en radios de 50, 100 y 200 m (Información Suplementaria y Tabla S1). Aunque las variables de porcentaje de bosque natural, potrero arbolado y potrero tradicional a diferentes radios estuvieron altamente correlacionadas, para las comparaciones se usaron solo los valores a un radio de 200 m. Así mismo, se estimaron las distancias a vías y quebradas. Estas covariables ambientales fueron usadas para una escogencia múltiple de modelos lineales generalizados que pudieran explicar las variables respuesta, para lo cual fueron estandarizadas (i.e., reescalonadas para tener como promedio 0). Se usó la función glmulti del paquete glmulti para generar automáticamente todos los posibles modelos. Para determinar el modelo más factible o mejor ajustado se usó el criterio de información de Akaike (AICc), considerando un ΔAICc < 2 para los modelos más robustos (Burnham & Anderson, 2004).
Análisis de paisajes sonoros. Cada grabación fue normalizada a -3 dB y se aplicó un filtro de paso alto de 150 Hz en el programa Ocenaudio, con el fin de disminuir un poco la cantidad de viento en algunas grabaciones, que dificultaba la visualización de emisiones acústicas de aves y anuros. Posteriormente, se cargaron en la plataforma de análisis bioacústico ARBIMON ll (https://arbimon.sieve-analytics.com) y se realizó un análisis de paisaje sonoro por agregación de grabaciones por hora, para obtener el comportamiento de la huella acústica de cada sitio (Campos-Cerqueira et al., 2019; Furumo & Aide, 2019; Herrera-Montes, 2018). Para obtener los paisajes sonoros, se definió la agregación de las grabaciones en escala de tiempo de la hora del día (24 h), un tamaño de intervalo de frecuencia de 21 Hz, un umbral de amplitud de 0.05 (relativo al pico máximo), y la distancia mínima entre picos a 0 Hz. Los parámetros fueron escogidos primero siguiendo estudios publicados (Campos-Cerqueira et al., 2019; Furumo & Aide, 2019; Herrera-Montes, 2018), y luego manteniendo la mejor representación ajustada a nuestros datos durante un análisis preliminar. La configuración de análisis de paisajes sonoros genera un total de 25 200 celdas (24 horas x 1050 bandas de frecuencia) para cada sitio, con información en cada celda de la proporción de grabaciones con picos de actividad acústica por encima del umbral definido.
Para comparar los paisajes sonoros, se realizó una ordenación no métrica multidimensional escalonada (NMDS) a partir de las celdas que arrojaron más información en alguno de los sitios (sumatoria de proporciones de grabaciones entre los sitios >1). Dichas celdas (806) incluyeron actividad acústica concentrada principalmente en frecuencias del espectro audible por debajo de los 10 kHz, rango de frecuencia que incluye la mayoría de los sonidos de aves y anfibios (Aide et al., 2017); por eso centramos los análisis para la ordenación solo en esa franja de frecuencia audible (0-10 kHz). La ordenación se corrió usando la distancia de disimilitud Jaccard, al ser datos de incidencia, con 20 permutaciones y a partir del uso de la función metaMDS. La matriz usada para correr la ordenación también sirvió para comparar los paisajes sonoros y relacionarlos con diferentes covariables ambientales, a partir de un análisis de varianza (ANDEVA) multivariado, con la función adonis, usando 999 permutaciones. Finalmente, comparamos la dispersión de los puntos de cada sistema con la función betadisper. Las tres funciones mencionadas pertenecen al paquete vegan en R (Oksanen et al., 2019).
Composición del paisaje sonoro y actividad acústica de aves y anuros. Se revisaron 15 grabaciones por hora, por día, por sitio aleatoriamente en las franjas de horas 06:00-07:00, 12:00-13:00, 18:00-19:00 y 00:00-01:00 con el fin de identificar los principales componentes del paisaje sonoro. En el caso de la finca La Pradera, tanto para potreros arbolados como para potrero tradicional, solamente se encontraron 6 archivos para el periodo de muestreo, al parecer debido a un fallo con la grabadora, así que revisamos el total de archivos en estos sitios (Tabla 2). Se anotó la presencia y ausencia de componentes del paisaje sonoro usando la herramienta en ARBIMON II “Composición de paisaje sonoro”; se seleccionaron, para cada grabación revisada, presencia de geofonía (viento, lluvia, movimiento de agua), biofonía (aves, anfibios, insectos, mamíferos, domésticos) y antropofonía (vehículos terrestres, vehículos aéreos, maquinaria, voces, sonidos eléctricos).
Tabla 2: Número de archivos revisados para la composición del paisaje sonoro en el departamento del Meta, Colombia, para noviembre de 2019. PA, potrero arbolado; PT, potrero tradicional.
Sitio
Hora
Total
12 AM
6 AM
12 PM
6 PM
PT_Porvenir_norm
14
15
15
14
58
PT_Andorra_norm
15
13
11
13
52
PT_Pradera_norm
6
6
7
6
25
PT_Rosania_norm
14
15
15
15
59
PA_Andorra_norm
13
14
13
16
56
PA_1Pradera_norm
14
11
15
15
55
PA_2Pradera_norm
6
6
5
5
22
PA_Rosania_norm
13
15
15
15
58
Total
95
95
96
99
385
Adicionalmente, se revisaron entre 30 y 40 grabaciones al azar de cada sitio durante el coro de amanecer (5:00-8:00) y el coro nocturno (17:00- 20:00), identificando principalmente aves y anuros. Aunque los insectos son uno de los principales componentes de la biofonía en sistemas tropicales (Aide et al., 2017), centramos este análisis en aves y anuros, dado que la mayor concentración de actividad acústica fue por debajo de los 10 kHz, y para poder identificar fielmente la mayoría de fuentes de sonido biótico. La revisión significó otras 587 grabaciones diferentes a las anteriormente revisadas para este componente específico de la biofonía de cada paisaje sonoro. Para la identificación de las especies se usaron como referencias bases de datos de sonidos de aves como xeno-canto (https://www.xeno-canto.org), Macaulay Library (https://www.macaulaylibrary.org), AmphibiaWeb (https://amphibiaweb.org), batrachia (https://www.batrachia.com) y archivos particulares de los autores. Con este conjunto de datos, comparamos las detecciones (número de grabaciones con presencia de alguna especie o componente del paisaje sonoro), la riqueza (número de especies del submuestreo) y composición (lista de especies) entre los sitios y tipos de potreros.
Para determinar las diferencias en la composición del paisaje sonoro entre los sistemas tradicionales y arbolados, se realizó un conteo de los dos grupos taxonómicos seleccionados (anuros y aves) y se estimó la riqueza de especies. Posteriormente, se realizó un modelo lineal generalizado que vinculaba la variable respuesta (conteo y riqueza de especies) con los factores fijos de sistema (tradicional o arbolado), componente (geofonía, biofonía, antropofonía) y grupo taxonómico (anuros y aves), así como sus interacciones. Cada modelo lineal generalizado fue vinculado con la función de enlace Poisson. Para determinar los tipos diferentes se realizó una prueba post-hoc de comparación múltiple de Tukey. Por su parte, se comparó la composición de especies entre los sitios con sistema tradicional o arbolado con el índice de disimilitud de Jaccard (Jaccard, 1912) . Entre más altos los valores del índice de Jaccard, más alto el recambio o mayor disimilitud entre los sitios.
Resultados
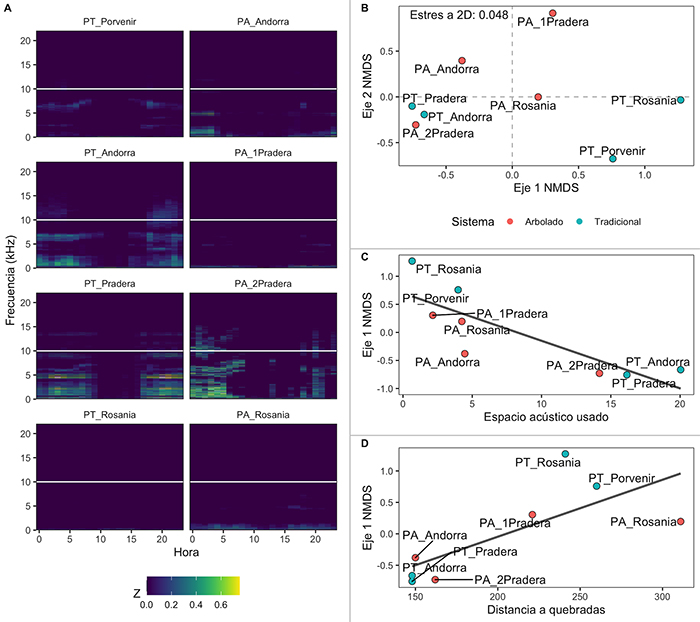
Se obtuvieron 4743 grabaciones de un minuto, 2717 para sistemas de potreros tradicionales y 2026 para potreros arbolados (Tabla 1). En promedio se muestreo 4.99 días por sitio, con algunas excepciones en el PA de finca La Pradera (Tabla 1), debido a una falla en la grabadora. La huella acústica de cada sitio representó, en general, actividad acústica en horas de la noche y principalmente por debajo de los 7 kHz de frecuencia (Figura 2A). El uso del espacio acústico en promedio fue del 4.46 %, pero varió entre sitios. Los sitios con mayor porcentaje de espacio acústico usado fueron PT_Andorra (20.04 %), PT_Pradera (16.16 %) y PA_2Pradera (14.18 %). Por otro lado, los sitios con menor uso del espacio acústico fueron PT_Rosania (0.66 %), PA_1Pradera (2.15 %), y PT_Porvenir (3.98 %).
Figura 2: Representación visual (A) y comparación (B) del paisaje acústico de ocho sitios muestreados en el departamento del Meta, Colombia (ver Tabla 1 para descripción de los sitios). A, Los ejes representan la hora del día (X), frecuencia en kHz (Y) y proporción de grabaciones con actividad por encima de un umbral de 0.05 (Z); nótese que la mayoría de la actividad se concentra por debajo de los 10 kHz (línea horizontal blanca). El uso del espacio se calculó por la suma de número de celdas de tiempo/banda de frecuencia que fuera ocupado. B, Ordenación multidimensional no métrica escalonada (NMDS) a partir de celdas de tiempo/banda de frecuencia por cada sitio con bandas de frecuencia hasta 10 kHz. Relación del eje 1 de NMDS con el espacio acústico usado (C) y con la distancia a quebradas (D).
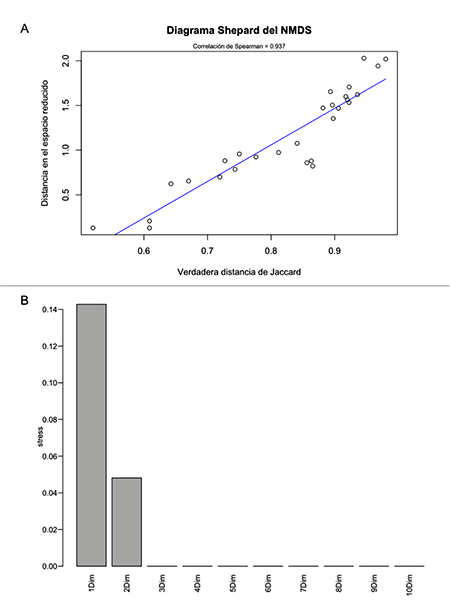
Al comparar los paisajes sonoros de los diferentes sitios por medio del NMDS (Figura 2B), el cual tuvo un valor de estrés de 0.048 con dos dimensiones (Figura S1), se observó que tanto los sistemas de potreros arbolados como los potreros tradicionales parecen distanciarse en el eje 2, con los potreros arbolados hacia valores positivos y potreros tradicionales hacia valores negativos, aunque la dispersión entre ellos no varió significativamente (F 1,6 = 0.630, P = 0.46). Aunque los sitios se ven aparentemente muy cercanos (promedio distancia 900 m, rango 241-15 963 m), la distancia a la grabadora más cercana no se correlaciona con ninguno de los ejes del NMSD, es decir que la ordenación es independiente de la distribución espacial de los sitios. El análisis de varianza (ANDEVA) mostró una variación que estuvo significativamente relacionada con el espacio acústico usado (Figura 2C; F 1,7 = 2.784, P = 0.02) y con la distancia a quebradas (Figura 2D; F 1,7 = 2.092, P = 0.05).
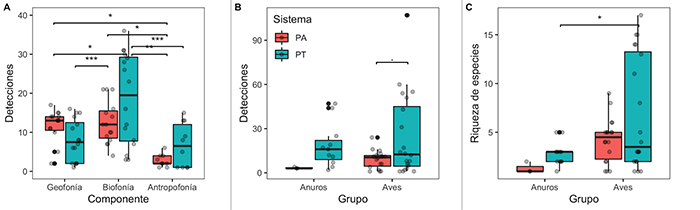
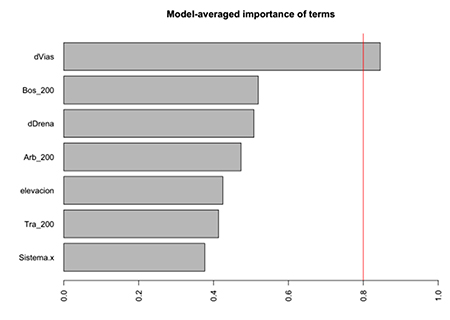
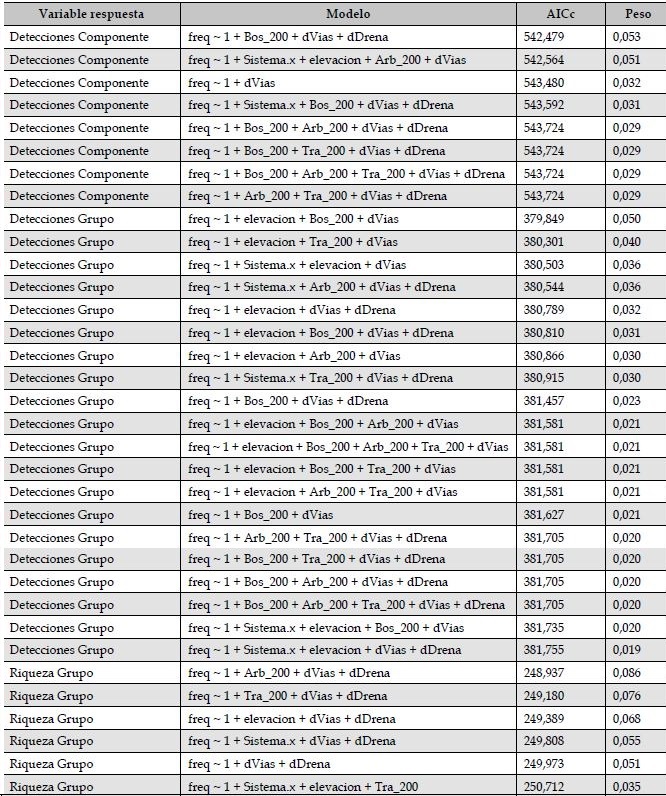
Los componentes del paisaje sonoro variaron diferencialmente entre los dos tipos de sistemas de potreros (Figura 3A). Los potreros arbolados se caracterizaron por bajas detecciones de antropofonía, mientras que geofonía y biofonía fueron similares. En potreros tradicionales, las detecciones de geofonía fueron similares a antropofonía, mientras que las detecciones de biofonía fueron más altas que antropofonía. Todos los modelos mejor ajustados (ΔAICc < 2) para las detecciones de componentes de paisajes sonoros incluyeron la distancia a vías como variable más importante (Tabla S2, Figura S2).
Figura 3: Variación del paisaje sonoro en potreros arbolados (PA) y potreros tradicionales (PT) en el departamento del Meta, Colombia. A, detecciones de componentes del paisaje sonoro (geofonía, biofonía o antropofonía); B, detecciones de anuros y aves; C, número de especies de anuros y aves reportadas por hora y sitio para sistemas silvopastoriles. Diagrama de cajas representa la mediana y el rango intercuartílico (IQR; 50 % de los datos), el bigote (línea vertical) se extiende +1.5 veces el IQR. Las líneas horizontales vinculan grupos significativamente diferentes (significancia: [.], P > 0.1; [*], P > 0.05; [**], P > 0.01; [***], P > 0.001)
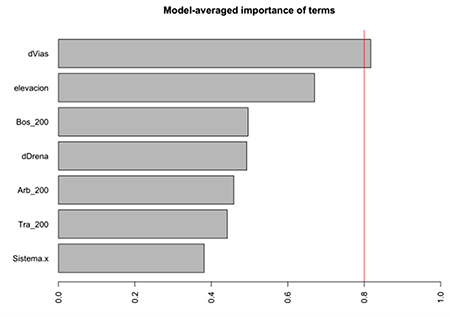
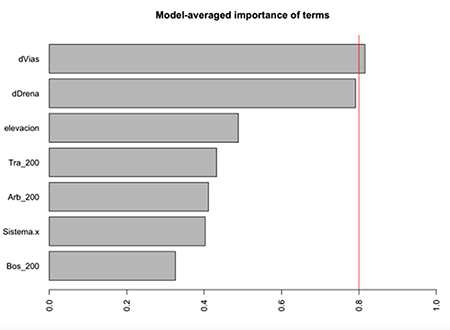
La mayor diferencia de las detecciones del componente biofonía se encontró en las aves (Tabla 3). Las detecciones de aves fueron marginalmente diferentes entre los dos sistemas (Figura 3B, P = 0.08). Sin embargo, se encontraron pocas detecciones de anuros en sistemas de potreros arbolados. Al igual que con las detecciones de componente de paisaje sonoro, todos los modelos mejor ajustados para las detecciones de los dos grupos taxonómicos revisados (aves y anuros) incluyeron la distancia a vías como variable más importante (Tabla S2, Figura S3). En cuanto al número de especies de anuros y aves (Figura 3C), la diferencia más marcada fue entre la riqueza de aves y anuros en potreros tradicionales (Figura 3c, P = 0.043). Cinco de los seis modelos mejor ajustados incluyeron las variables distancia a vías y distancia a quebradas como las variables más importantes para explicar la variación de riqueza de estos dos grupos (Tabla S2, Figura S4). Aunque no se profundizó en la identificación de insectos acústicamente activos, se obtuvieron 237 detecciones (102 para potreros arbolados y 135 para potreros tradicionales).
Tabla 3: Efecto de sistema (PT, potreros tradicionales), componente del paisaje sonoro (B, biofonía; G, geofonía), grupo de aves (Av) e interacciones sobre las detecciones del componente sonoro, detecciones de anuros o aves y número de especies de anuros y aves, en el departamento del Meta, Colombia
Detecciones por componente sonoro
Detecciones de anuros o aves
Riqueza de especies de anuros y aves
Coef + SE
P
Coef + SE
P
Coef + SE
P
Intercepto
1.02 + 0.20
<0.001
1.20 + 0.32
<0.001
0.29 + 0.50
0.565
Sistema (PT)
0.88 + 0.23
<0.001
1.72 + 0.32
<0.001
0.75 + 0.53
0.159
Componente (B)
1.50 + 0.21
<0.001
-
-
-
-
Grupo (Av)
-
-
1.01 + 0.33
0.002
1.15 + 0.51
0.025
Componente (G)
1.40 + 0.21
<0.001
-
-
-
-
Sistema (PT)*Componente (B)
-0.48 + 0.25
0.058
-
-
-
-
Sistema (PT)*Grupo (Av)
-
-
-0.72 + 0.34
0.032
-0.27 + 0.55
0.631
Sistema (PT)*Componente (G)
-1.23 + 0.26
<0.001
-
-
-
-
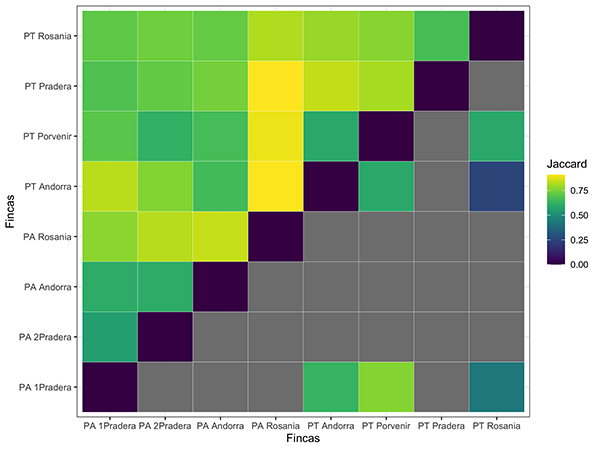
Figura 4: Matriz de disimilitud por pares entre las fincas muestreadas para sonidos de aves (arriba de la diagonal) y anuros (debajo de la diagonal) en el departamento del Meta, Colombia. El índice de Jaccard fue calculado a partir de la presencia de especies detectada en 587 grabaciones revisadas. Los valores más altos (más amarillos) indican una mayor disimilitud entre sitios pareados. Bloques grises representan sitios que no tuvieron presencia de anuros durante la revisión de coros de amanecer (5:00-8:00) o nocturno (17:00-20:00).
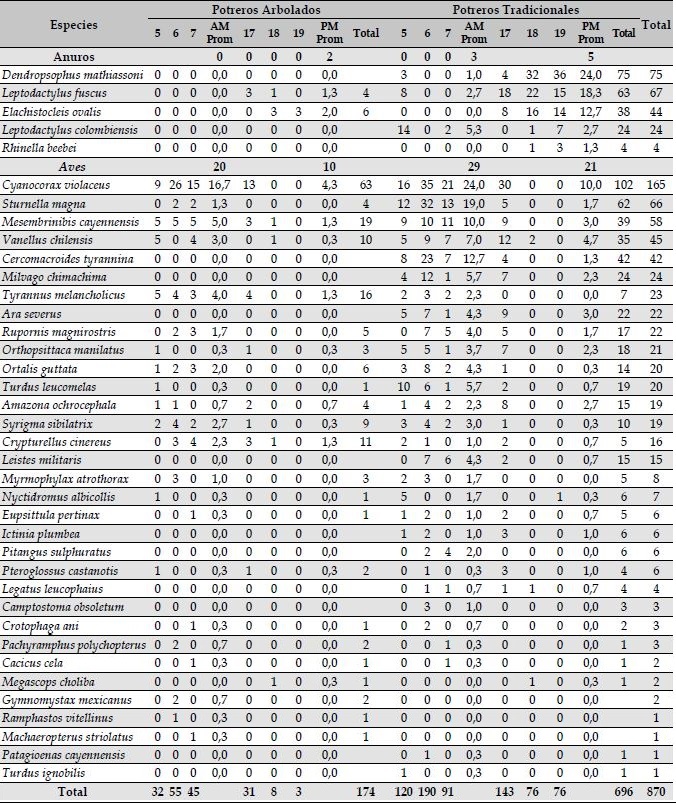
Al revisar la lista de especies detectadas, se resalta la poca diversidad total reportada en potreros arbolados, con 2 especies de anuros y 23 especies de aves (Tabla 4, ver datos extendidos en Tabla S3). Por su parte, los potreros tradicionales registraron 5 especies de anuros y 30 especies de aves. La especie de anuro con más detecciones fue Dendropsophus mathiassoni, únicamente registrado en potreros tradicionales, principalmente al atardecer, seguido por Leptodactylus fuscus presente en ambos sistemas, pero con muchas más detecciones (59) en potrero tradicional. El ave con mayor número de detecciones fue Cyanocorax violaceus, seguido por Sturnella magna y Mesembrinibis cayennensis, registrados en ambos sistemas, pero mayoritariamente en potreros tradicionales. Este patrón se mantuvo para casi todas las especies, excepto Tyrannus melancholicus, Crypturellus cinereus, Pachyramphus polychopterus, Gymnomystax mexicanus, Ramphastos vitellinus y Machaeropterus striolatus (Tabla 4), que tuvieron más detecciones en potreros arbolados que en tradicionales.
Tabla 4: Listado de especies de anuros y aves registrados en coros de amanecer (AM: 05:00-08:00) y coro nocturno (PM: 17:00- 20:00) en potreros arbolados y tradicionales en el piedemonte llanero del departamento del Meta, Colombia. Los números indican el promedio de grabaciones con detecciones positivas por franja (AM y PM), así como el total de detecciones para cada sistema y general por especie.
Especies
Potreros Arbolados
Potreros Tradicionales
Total
AM
PM
Total
AM
PM
Total
Anuros
Dendropsophus mathiassoni
0.0
0.0
1.0
24.0
75
75
Leptodactylus fuscus
0.0
1.3
4
2.7
18.3
63
67
Elachistocleis ovalis
0.0
2.0
6
0.0
12.7
38
44
Leptodactylus colombiensis
0.0
0.0
5.3
2.7
24
24
Rhinella beebei
0.0
0.0
0.0
1.3
4
4
Aves
Cyanocorax violaceus
16.7
4.3
63
24.0
10.0
102
165
Sturnella magna
1.3
0.0
4
19.0
1.7
62
66
Mesembrinibis cayennensis
5.0
1.3
19
10.0
3.0
39
58
Vanellus chilensis
3.0
0.3
10
7.0
4.7
35
45
Cercomacroides tyrannina
0.0
0.0
12.7
1.3
42
42
Milvago chimachima
0.0
0.0
5.7
2.3
24
24
Tyrannus melancholicus
4.0
1.3
16
2.3
0.0
7
23
Ara severus
0.0
0.0
4.3
3.0
22
22
Rupornis magnirostris
1.7
0.0
5
4.0
1.7
17
22
Orthopsittaca manilatus
0.3
0.3
3
3.7
2.3
18
21
Ortalis guttata
2.0
0.0
6
4.3
0.3
14
20
Turdus leucomelas
0.3
0.0
1
5.7
0.7
19
20
Amazona ochrocephala
0.7
0.7
4
2.3
2.7
15
19
Syrigma sibilatrix
2.7
0.3
9
3.0
0.3
10
19
Crypturellus cinereus
2.3
1.3
11
1.0
0.7
5
16
Leistes militaris
0.0
0.0
4.3
0.7
15
15
Myrmophylax atrothorax
1.0
0.0
3
1.7
0.0
5
8
Nyctidromus albicollis
0.3
0.0
1
1.7
0.3
6
7
Eupsittula pertinax
0.3
0.0
1
1.0
0.7
5
6
Ictinia plumbea
0.0
0.0
1.0
1.0
6
6
Pitangus sulphuratus
0.0
0.0
2.0
0.0
6
6
Pteroglossus castanotis
0.3
0.3
2
0.3
1.0
4
6
Legatus leucophaius
0.0
0.0
0.7
0.7
4
4
Camptostoma obsoletum
0.0
0.0
1.0
0.0
3
3
Crotophaga ani
0.3
0.0
1
0.7
0.0
2
3
Pachyramphus polychopterus
0.7
0.0
2
0.3
0.0
1
3
Cacicus cela
0.3
0.0
1
0.3
0.0
1
2
Megascops choliba
0.0
0.3
1
0.0
0.3
1
2
Gymnomystax mexicanus
0.7
0.0
2
0.0
0.0
2
Ramphastos vitellinus
0.3
0.0
1
0.0
0.0
1
Machaeropterus striolatus
0.3
0.0
1
0.0
0.0
1
Patagioenas cayennensis
0.0
0.0
0.3
0.0
1
1
Turdus ignobilis
0.0
0.0
0.3
0.0
1
1
Total
174
696
870
El índice de disimilitud de Jaccard fue más alto en las comparaciones del sitio PA_Rosania con los potreros tradicionales de PT_Pradera, PT_Andorra y PT_Porvenir (Figura 4). Esto indica que hay un mayor recambio entre estos sitios. Sin embargo, PA_Rosania presentó un recambio de especies considerable con relación a los potreros arbolados, como PA_2Pradera y PA_Andorra. Esta disimilitud ocurrió también en fincas de potreros tradicionales, como la comparación de las fincas Pradera y Andorra. La comunidad de anuros tuvo muy pocas detecciones para poder hacer comparaciones adecuadas en el recambio de especies, pero los valores de mayor disimilitud estuvieron entre PT_Porvenir y PA_1Pradera. Al contrario, la comparación pareada con menor recambio estuvo entre PT_Andorra y PT_Rosania.
Discusión
Los resultados en este estudio resaltan las diferencias en el paisaje sonoro y actividad acústica entre los sistemas de potreros arbolados y tradicionales, en particular relacionados con la distancia a las vías y a las quebradas. En el caso de los sistemas de potreros arbolados no hay una relación clara, pero para los potreros tradicionales, a menor distancia de quebradas, mayor el uso del espacio acústico y viceversa (Tabla S1). Las quebradas en el área de estudio están asociadas a parches de bosque y probablemente esto permita establecimiento de mayor número de especies acústicamente activas cerca de los potreros tradicionales. Uno de los potreros arbolados (PA_2Pradera) resultó muy similar a algunos potreros tradicionales (PT_Andorra, PT_Pradera), con mayor actividad acústica, lo cual refleja un patrón de zona abierta, donde el paisaje acústico es saturado por la actividad de insectos y anfibios, similar a lo encontrado en un estudio de sistemas productivos (pastos para ganado, cultivos de arroz) al norte de Colombia (Furumo & Aide, 2019). Si bien los bosques tropicales intactos poseen mayor diversidad acústica que sistemas agroforestales o agrícolas (Burivalova et al., 2019), es importante tener en cuenta la importancia de la heterogeneidad espacial a la hora de conservar y mantener la diversidad en los sistemas agrícolas en paisajes dominados por humanos (Fahrig et al., 2011).
En cuanto a los componentes del paisaje sonoro y riqueza de grupos indicadores, también se encontraron diferencias entre los sistemas ganaderos tradicionales y sistemas silvopastoriles, en especial en el componente de biofonía, explicada por las aves. Aun así, otros componentes no analizados en detalle en este estudio pueden estar influenciando los paisajes sonoros del piedemonte de la Orinoquia (p. ej., insectos; Aide et al., 2017).
Contrario a lo que se esperaba, los sistemas de potreros arbolados presentaron menor riqueza de aves y anuros. Esto puede estar relacionado con la ya mencionada cercanía a quebradas con los relictos de bosque en potreros tradicionales, pero también con el diseño del sistema silvopatoril, que involucra árboles de falso yopo (M. trianae) de la misma edad, en ocasiones muy cercanos entre sí, lo cual podría considerarse un monocultivo de yopo. Sería ideal poder incrementar la heterogeneidad en los árboles sembrados y aumentar la distancia entre los mismos, como estrategia de mantenimiento de biodiversidad (Hendershot et al., 2020). Igualmente, integrar diseños que involucren diferentes estados sucesionales y por ende estructuras que permitan la colonización de otro tipo de biota en los sistemas silvopastoriles (Acevedo-Charry & Aide, 2019). Dentro de las nuevas propuestas de sistemas agroforestales (silvopastoriles) para la conservación de la biodiversidad y soberanía alimentaria se plantea un manejo con palmas de regeneración (p. ej., Acronomia aculeata) y diferentes especies de árboles maderables (p. ej. Swietenia macrophylla, Erythrina, Inga, Ficus), lo cual podría ser una herramienta prometedora para aumentar la diversidad de especies leñosas nativas en tierras degradadas (Calle et al., 2017). Sin embargo, esto requiere esfuerzos de largo plazo y depende de los recursos e incentivos de programas estatales y globales, además de la disposición de los propietarios (Acevedo-Charry & Aide, 2019).
Nuestros resultados mostraron una mayor detección de individuos de anuros en sistemas de potrero tradicional, lo cual posiblemente está determinado por la disponibilidad de cuerpos de agua temporales o permanentes, que son dispuestos en los sistemas tradicionales para permitir el acceso del ganado al agua, como bebederos artificiales. Igualmente, el pisoteo reiterado del ganado cambia las condiciones del suelo, generando pequeñas charchas que pueden ser aprovechadas por especies del género Leptodactylus (Angarita-Sierra, 2014). Esta opción puede ocurrir en la mayoría de las fincas que manejan más de 300 cabezas de ganado, a excepción de El Porvenir, que maneja 70-80 cabezas. Por ejemplo, L. fuscus y L. colombiensis depositan sus huevos en nidos de espuma que flotan en cuerpos de agua de sistemas lénticos y las larvas salen del nido a la charca (Crump, 1974). Las especies más abundantes en nuestro estudio, D. mathiassoni, E. ovalis y R. beebei, tienen una estrategia reproductiva caracterizada por depositar huevos en cuerpos de agua lénticos, y sus larvas tienen desarrollo acuático (Crump, 1974). Adicionalmente, se ha documentado que algunas especies generalistas de anuros (Rhinella marina y Boana punctata) aprovechan los cuerpos de agua en áreas abiertas como medio de reproducción (Acevedo-Charry & Aide, 2019).
Futuras aproximaciones al paisaje sonoro neotropical deben incluir detecciones de insectos (Aide et al., 2017; Bobryk et al., 2015; Furumo & Aide, 2019), que ocupan un amplio rango de frecuencia en espectro audible (Aide et al., 2017). A pesar de que no fue evaluado cuantitativamente, en este estudio también se detectaron especies de mamíferos como Dactylomys dactylinus, especialistas de bambú (Emmons, 1981; LaVal, 1976; Reyes Díaz, 2019). Los registros de esta especie se encontraron asociados a tres potreros tradicionales (fincas Andorra, Rosania y Porvenir) y dos potreros arbolados (fincas Andorra, Rosania) cercanos a bosque y quebradas. Adicionalmente, se detectaron también mamíferos grandes y perseguidos por conflicto con ganaderos, como Panthera onca en potreros arbolados en la finca Rosania y Puma concolor en potrero tradicional en la finca Andorra, en ambos casos relativamente cerca a un bosque. Aunque ambas especies son nativas, de amplia distribución y generalistas en sus presas, la disponibilidad de presas y reducción de hábitat podría atraerlas a los sistemas productivos de ganadería (Garrote et al., 2017). Aun así, estos registros sugieren que los parches de bosque conservados en las fincas contribuyen a mantener posibles movimientos de estas especies dentro de los predios (Polisar et al., 2003) y postula posibles oportunidades de conservación en estos sistemas productivos en una escala regional.
La industria agrícola y ganadera seguirá recibiendo cada vez más presión para ser simultáneamente productiva y sostenible, así que la atención a tecnicas novedosas que apoyen sus decisiones de manejo seguirá siendo relevante. El uso de técnicas de monitoreo acústico muestra tener un gran potencial ya que puede ser fácilmente estandarizada y aplicada a gran escala para proveer indicadores del impacto y la sostenibilidad de la industria agrícola (Doohan et al., 2019). Es importante que se propicie que los sistemas silvopastoriles generen una estructura más heterogénea y se conviertan en hábitat para otras plantas y animales, de forma que ayuden a incrementar la biodiversidad y mantener diferentes procesos ecológicos vitales en los paisajes ganaderos (Jose et al., 2019; Murgueitio et al., 2013; Rivera et al., 2013).
Anexos
Figura S1: Estudio de paisajes sonoros en el departamento del Meta, Colombia. A, diagrama de Shepard para verificación y visualización de calidad en la representación en dos dimensiones para NMDS; B, gráfico de barras del valor de estrés de la ordenación para diferentes dimensiones (nótese que después de dos dimensiones el estrés declina drásticamente).
Figura S2: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Importancia de variables en selección de modelos para detecciones de componente de paisaje sonoro.
Figura S3: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Importancia de variables en selección de modelos para detecciones de aves y anuros.
Figura S4: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Importancia de variables en selección de modelos para riqueza de aves y anuros
Tabla S1: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Variables ambientales para los diferentes sitios muestreados
Sitio
Porcentaje de Espacio Acustico
Elevación (m)
% Bosque en radio 200 m
% Arbolado en radio 200 m
% P. Tradicional en radio 200m
% Bosque en radio 100 m
% P. Arbolado en radio 100 m
% P. Tradicional en radio 100m
% Bosque en radio 50 m
% P. Arbolado en radio 50 m
% P. Tradicional en radio 50m
Distancia a vías (m)
Distancia a cuenca o microcuenca (m)
PT_Porvenir_norm
7.960
424
7.344
17.336
75.321
0.000
7.214
92.786
0.001
0.000
100.000
240
260
PT_Andorra_norm
28.060
534
5.568
9.997
84.435
0.000
0.000
100.000
0.000
0.000
100.000
485
148
PT_Pradera_norm
21.520
560
1.053
19.385
79.561
0.000
0.621
99.379
0.000
0.000
100.000
1665
148
PT_Rosania_norm
0.960
770
4.021
5.288
90.691
0.000
0.526
99.947
0.000
0.000
100.000
1153
241
PA_Andorra_norm
6.990
520
1.607
81.694
16.700
0.435
98.792
0.773
1.744
96.532
1.724
1389
150
PA_1Pradera_norm
2.180
525
0.140
91.579
8.281
0.000
99.936
0.064
0.000
100.000
0.000
1723
221
PA_2Pradera_norm
14.180
525
2.165
76.503
21.332
0.000
99.565
0.435
0.000
100.000
0.000
1550
162
PA_Rosania_norm
5.830
738
19.409
48.536
32.055
7.796
65.559
26.644
14.175
78.501
7.323
686
311
Tabla S2: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Modelos mas posibles (ΔAICc < 2) para variables explicativas de tres variables respuesta
Variable respuesta
Modelo
AICc
Peso
Detecciones Componente
freq ~ 1 + Bos_200 + dVias + dDrena
542.479
0.053
Detecciones Componente
freq ~ 1 + Sistema.x + elevacion + Arb_200 + dVias
542.564
0.051
Detecciones Componente
freq ~ 1 + dVias
543.480
0.032
Detecciones Componente
freq ~ 1 + Sistema.x + Bos_200 + dVias + dDrena
543.592
0.031
Detecciones Componente
freq ~ 1 + Bos_200 + Arb_200 + dVias + dDrena
543.724
0.029
Detecciones Componente
freq ~ 1 + Bos_200 + Tra_200 + dVias + dDrena
543.724
0.029
Detecciones Componente
freq ~ 1 + Bos_200 + Arb_200 + Tra_200 + dVias + dDrena
543.724
0.029
Detecciones Componente
freq ~ 1 + Arb_200 + Tra_200 + dVias + dDrena
543.724
0.029
Detecciones Grupo
freq ~ 1 + elevacion + Bos_200 + dVias
379.849
0.050
Detecciones Grupo
freq ~ 1 + elevacion + Tra_200 + dVias
380.301
0.040
Detecciones Grupo
freq ~ 1 + Sistema.x + elevacion + dVias
380.503
0.036
Detecciones Grupo
freq ~ 1 + Sistema.x + Arb_200 + dVias + dDrena
380.544
0.036
Detecciones Grupo
freq ~ 1 + elevacion + dVias + dDrena
380.789
0.032
Detecciones Grupo
freq ~ 1 + elevacion + Bos_200 + dVias + dDrena
380.810
0.031
Detecciones Grupo
freq ~ 1 + elevacion + Arb_200 + dVias
380.866
0.030
Detecciones Grupo
freq ~ 1 + Sistema.x + Tra_200 + dVias + dDrena
380.915
0.030
Detecciones Grupo
freq ~ 1 + Bos_200 + dVias + dDrena
381.457
0.023
Detecciones Grupo
freq ~ 1 + elevacion + Bos_200 + Arb_200 + dVias
381.581
0.021
Detecciones Grupo
freq ~ 1 + elevacion + Bos_200 + Arb_200 + Tra_200 + dVias
381.581
0.021
Detecciones Grupo
freq ~ 1 + elevacion + Bos_200 + Tra_200 + dVias
381.581
0.021
Detecciones Grupo
freq ~ 1 + elevacion + Arb_200 + Tra_200 + dVias
381.581
0.021
Detecciones Grupo
freq ~ 1 + Bos_200 + dVias
381.627
0.021
Detecciones Grupo
freq ~ 1 + Arb_200 + Tra_200 + dVias + dDrena
381.705
0.020
Detecciones Grupo
freq ~ 1 + Bos_200 + Tra_200 + dVias + dDrena
381.705
0.020
Detecciones Grupo
freq ~ 1 + Bos_200 + Arb_200 + dVias + dDrena
381.705
0.020
Detecciones Grupo
freq ~ 1 + Bos_200 + Arb_200 + Tra_200 + dVias + dDrena
381.705
0.020
Detecciones Grupo
freq ~ 1 + Sistema.x + elevacion + Bos_200 + dVias
381.735
0.020
Detecciones Grupo
freq ~ 1 + Sistema.x + elevacion + dVias + dDrena
381.755
0.019
Riqueza Grupo
freq ~ 1 + Arb_200 + dVias + dDrena
248.937
0.086
Riqueza Grupo
freq ~ 1 + Tra_200 + dVias + dDrena
249.180
0.076
Riqueza Grupo
freq ~ 1 + elevacion + dVias + dDrena
249.389
0.068
Riqueza Grupo
freq ~ 1 + Sistema.x + dVias + dDrena
249.808
0.055
Riqueza Grupo
freq ~ 1 + dVias + dDrena
249.973
0.051
Riqueza Grupo
freq ~ 1 + Sistema.x + elevacion + Tra_200
250.712
0.035
Tabla S3: Estudio de paisajes sonoros en el departamento del Meta, Colombia. Lista de especies de anuros y aves con detecciones para cada especie (número de grabaciones).
Especies
Potreros Arbolados
Potreros Tradicionales
Total
5
6
7
AM Prom
17
18
19
PM Prom
Total
5
6
7
AM Prom
17
18
19
PM Prom
Total
Anuros
0
0
0
0
2
0
0
0
3
5
Dendropsophus mathiassoni
0
0
0
0,0
0
0
0
0,0
3
0
0
1,0
4
32
36
24,0
75
75
Leptodactylus fuscus
0
0
0
0,0
3
1
0
1,3
4
8
0
0
2,7
18
22
15
18,3
63
67
Elachistocleis ovalis
0
0
0
0,0
0
3
3
2,0
6
0
0
0
0,0
8
16
14
12,7
38
44
Leptodactylus colombiensis
0
0
0
0,0
0
0
0
0,0
14
0
2
5,3
0
1
7
2,7
24
24
Rhinella beebei
0
0
0
0,0
0
0
0
0,0
0
0
0
0,0
0
1
3
1,3
4
4
Aves
20
10
29
21
Cyanocorax violaceus
9
26
15
16,7
13
0
0
4,3
63
16
35
21
24,0
30
0
0
10,0
102
165
Sturnella magna
0
2
2
1,3
0
0
0
0,0
4
12
32
13
19,0
5
0
0
1,7
62
66
Mesembrinibis cayennensis
5
5
5
5,0
3
1
0
1,3
19
9
10
11
10,0
9
0
0
3,0
39
58
Vanellus chilensis
5
0
4
3,0
0
1
0
0,3
10
5
9
7
7,0
12
2
0
4,7
35
45
Cercomacroides tyrannina
0
0
0
0,0
0
0
0
0,0
8
23
7
12,7
4
0
0
1,3
42
42
Milvago chimachima
0
0
0
0,0
0
0
0
0,0
4
12
1
5,7
7
0
0
2,3
24
24
Tyrannus melancholicus
5
4
3
4,0
4
0
0
1,3
16
2
3
2
2,3
0
0
0
0,0
7
23
Ara severus
0
0
0
0,0
0
0
0
0,0
5
7
1
4,3
9
0
0
3,0
22
22
Rupornis magnirostris
0
2
3
1,7
0
0
0
0,0
5
0
7
5
4,0
5
0
0
1,7
17
22
Orthopsittaca manilatus
1
0
0
0,3
1
0
0
0,3
3
5
5
1
3,7
7
0
0
2,3
18
21
Ortalis guttata
1
2
3
2,0
0
0
0
0,0
6
3
8
2
4,3
1
0
0
0,3
14
20
Turdus leucomelas
1
0
0
0,3
0
0
0
0,0
1
10
6
1
5,7
2
0
0
0,7
19
20
Amazona ochrocephala
1
1
0
0,7
2
0
0
0,7
4
1
4
2
2,3
8
0
0
2,7
15
19
Syrigma sibilatrix
2
4
2
2,7
1
0
0
0,3
9
3
4
2
3,0
1
0
0
0,3
10
19
Crypturellus cinereus
0
3
4
2,3
3
1
0
1,3
11
2
1
0
1,0
2
0
0
0,7
5
16
Leistes militaris
0
0
0
0,0
0
0
0
0,0
0
7
6
4,3
2
0
0
0,7
15
15
Myrmophylax atrothorax
0
3
0
1,0
0
0
0
0,0
3
2
3
0
1,7
0
0
0
0,0
5
8
Nyctidromus albicollis
1
0
0
0,3
0
0
0
0,0
1
5
0
0
1,7
0
0
1
0,3
6
7
Eupsittula pertinax
0
0
1
0,3
0
0
0
0,0
1
1
2
0
1,0
2
0
0
0,7
5
6
Ictinia plumbea
0
0
0
0,0
0
0
0
0,0
1
2
0
1,0
3
0
0
1,0
6
6
Pitangus sulphuratus
0
0
0
0,0
0
0
0
0,0
0
2
4
2,0
0
0
0
0,0
6
6
Pteroglossus castanotis
1
0
0
0,3
1
0
0
0,3
2
0
1
0
0,3
3
0
0
1,0
4
6
Legatus leucophaius
0
0
0
0,0
0
0
0
0,0
0
1
1
0,7
1
1
0
0,7
4
4
Camptostoma obsoletum
0
0
0
0,0
0
0
0
0,0
0
3
0
1,0
0
0
0
0,0
3
3
Crotophaga ani
0
0
1
0,3
0
0
0
0,0
1
0
2
0
0,7
0
0
0
0,0
2
3
Pachyramphus polychopterus
0
2
0
0,7
0
0
0
0,0
2
0
0
1
0,3
0
0
0
0,0
1
3
Cacicus cela
0
0
1
0,3
0
0
0
0,0
1
0
0
1
0,3
0
0
0
0,0
1
2
Megascops choliba
0
0
0
0,0
0
1
0
0,3
1
0
0
0
0,0
0
1
0
0,3
1
2
Gymnomystax mexicanus
0
2
0
0,7
0
0
0
0,0
2
0
0
0
0,0
0
0
0
0,0
2
Ramphastos vitellinus
0
1
0
0,3
0
0
0
0,0
1
0
0
0
0,0
0
0
0
0,0
1
Machaeropterus striolatus
0
0
1
0,3
0
0
0
0,0
1
0
0
0
0,0
0
0
0
0,0
1
Patagioenas cayennensis
0
0
0
0,0
0
0
0
0,0
0
1
0
0,3
0
0
0
0,0
1
1
Turdus ignobilis
0
0
0
0,0
0
0
0
0,0
1
0
0
0,3
0
0
0
0,0
1
1
Total
32
55
45
31
8
3
174
120
190
91
143
76
76
696
870