Recibido: 9 de julio de 2020; Aceptado: 15 de noviembre de 2020
Resumen
Las señales acústicas son una de las formas de comunicación más importante en la fauna, incluso en la ubicación espacial de los individuos y sus presas. El estudio de las señales acústicas fortalece los campos de investigación en ecología, comportamiento, identificación taxonómica, uso de hábitat e incluso el efecto de las actividades humanas sobre diferentes especies animales. Además, es una herramienta para la cuantificación y monitoreo de la biodiversidad. En este trabajo presentamos un análisis de los estudios basados en bioacústica que se han desarrollado en Colombia, con el fin de establecer una línea base e identificar vacíos en el conocimiento, sus fortalezas y debilidades, para discutir los retos futuros para el desarrollo de la investigación sobre bioacústica en el país. Nuestra búsqueda de información se concentró en publicaciones de tipo científico, trabajos de grado y presentaciones en conferencias, a partir de plataformas de datos electrónicos, usando diferentes palabras claves. En total obtuvimos 321 trabajos, en los que los grupos taxonómicaos más estudiados fueron las aves (36.4%) y los anfibios (35%). La mayoría de los trabajos se concentran en la región Andina (63%). La bioacústica es un campo con un creciente interés y, por ende, resulta necesario el trabajo colaborativo y multidisciplinario, la consolidación en las metodologías y el fortalecimiento y enriquecimiento de las colecciones de sonidos del país.
Palabras clave:
Bioacústica, Comunicación, Ecoacústica, Sonido, Vocalización..Abstract
Acoustic signals are one of the most important ways of communication for fauna. The study of acoustic signals constitutes a valuable tool to obtain information on ecology, behavior, taxonomic identification, and the effect of human activities in natural environments and different animal species. Furthermore, it offers the possibility of quantifying and monitoring biodiversity in different Colombian ecosystems. In this work, we present an analysis of the research on bioacoustics that have been developed in Colombia, to establish a baseline, identify gaps in knowledge, strengths, weaknesses and discuss future challenges for bioacoustics research in Colombia. We searched information on scientific publications, degree papers, and electronic database conference presentations, using different keywords. We obtained 321 results;studies using acoustic tools are much more common in birds (36.4%) and amphibians (35%) than in any other taxonomic group, and there is a bias towards studying bioacoustics in the Andean region. However, this is a field with growing interest, and, therefore, there is a need for collaborative and multidisciplinary work, a consensus on methodologies, along with the strengthening and enrichment of the country’s sound collections.
Key words:
Bioacoustics, Communication, Ecoacoustics, Sound, Vocalization..Introducción
Las señales acústicas han evolucionado en diversos grupos de animales, en los que cumplen diferentes funciones, como defender el territorio, alertar sobre la presencia de depredadores, mantener la cohesión de los grupos mixtos, atraer la atención de una posible pareja, e incluso localizar a los individuos y detectar a las presas (Bradbury & Veherencamp, 2011). La bioacústica es una disciplina que estudia la emisión de sonido por parte de los organismos, su difusión a través de un medio elástico y, finalmente, su recepción y los eventuales cambios en el comportamiento del receptor, dada la información contenida. En general, las señales acústicas emitidas por animales dan información sobre su presencia en un lugar y tiempo determinado (Sousa-Lima et al., 2013), lo que permite que los monitoreos acústicos puedan ser una herramienta útil para estudiar la biodiversidad en diferentes escalas y a través del tiempo (Pijanowski et al., 2011; Aide et al., 2013; Deichmann et al., 2018).
Los monitoreos acústicos permiten responder a una gran variedad de preguntas ecológicas, ya que se puede tomar una gran cantidad de datos. Esto permite entender las respuestas de las especies ante la degradación de los hábitats, y de esta manera se pueden implementar medidas de manejo o conservación (Sethi et al., 2020). Recientemente, este campo ha tenido un crecimiento constante, debido al avance en las tecnologías de grabación de audio y la capacidad de análisis de las señales acústicas. En Colombia hay un creciente interés por el uso de la acústica para responder preguntas relacionadas con la taxonomía, sistemática, ecología, evolución y conservación. No obstante, el conocimiento sobre las interacciones acústicas de las especies en los ecosistemas colombianos está en una etapa temprana de desarrollo. En este trabajo, presentamos un diagnóstico general sobre el estado de la investigación de estudios en acústica en Colombia, con el fin de analizar sus aplicaciones actuales y potenciales en el conocimiento y monitoreo de la biodiversidad.
Materiales y métodos
Revisamos información publicada sobre estudios de bioacústica para seis grupos taxonómicos: insectos, peces, anfibios, reptiles, aves y mamíferos. Esta recopilación estuvo centrada en investigaciones que responden preguntas relacionadas con el estudio de acústica y publicaciones que usan herramientas acústicas para responder preguntas ecológicas, comportamentales, evolutivas, entre otras. Para ello, realizamos una búsqueda Booleana de literatura primaria (artículos), secundaria (libros y capítulos de libros), literatura primaria en proceso de revisión, pero disponible en repositorios abiertos (Preprint) y literatura gris (trabajos de grado y conferencias) que fueran citados en Google Scholar y ResearchGate desde 1990 hasta junio del 2020. Realizamos la búsqueda usando las siguientes palabras clave para todos los grupos: “Bioacústica”, “sonido”, “Colombia” y palabras específicas para cada grupo (Tabla 1), usando la conjunción “AND”. Realizamos la búsqueda en inglés y en español, excluyendo fuentes como informes técnicos y páginas web. Para nuestro análisis, construimos matrices de frecuencia con el fin de ver la tendencia temporal, la región del país en el que se desarrolló el trabajo, el tipo de literatura y la tendencia temática para cada uno de los seis grupos mencionados. Para esto último, seleccionamos en total 12 temáticas (Tabla 1) y catalogamos cada una de las publicaciones de acuerdo a las temáticas tratadas.
Tabla 1: Palabras clave utilizadas en la búsqueda de publicaciones sobre bioacústica, por grupo taxonómico. En la parte inferior se enumeran las temáticas encontradas.
Grupo
Palabras Clave
Insectos
Acústica, comunicación acústica, insectos, Orthoptera, Diptera, Hemiptera, Coleoptera
Peces
Peces, peces agua dulce, peces marinos, sonidos peces, monitoreo acústico pasivo, peces soníferos
Anfibios
Acústica, vocalizaciones, cantos de anuncio, llamados de advertencia,comunicación de anuros
Reptiles
Acústica, vocalizaciones, cloqueo, sonajero, traqueteo, bramido, pujido, chirridos
Aves
Vocalizaciones, aves, acústica, cantos
Mamíferos
Acústica, vocalizaciones, mamíferos, señales acústicas, ecolocalización, Didelphimorphia, Primates, Cetácea, Carnívora, Chiroptera, Artiodactyla, Perissodactyla, Sirenia y Rodentia
Temáticas:
1. Descripción/delimitación: Descripción acústica de especies o delimitación taxonómica de especies.
2. Paisaje sonoro: Suma de todos los sonidos de un lugar en un momento en particular.
3. Trabajos de revisión: Trabajos de revisión en bioacústica.
4. Inventarios: Acústica como herramienta para inventarios de especies.
5. Ecología: Estudios en ecología con uso de herramientas acústicas.
6. Conservación: Estudios en conservación con uso de herramientas acústicas.
7. Comportamiento: Estudios en comportamiento con descripciones acústicas o uso de herramientas acústicas.
8. Evolución: Estudios evolutivos en acústica.
9. Divulgación: Obras de divulgación de sonidos.
10. Biomecánica: Anatomía y producción sonora.
11. Control plagas/vectores: Manejo de vectores o control de plagas a través de herramientas acústicas.
12. Informática: Desarrollos informáticos para bioacústica y ecoacústica.
Resultados
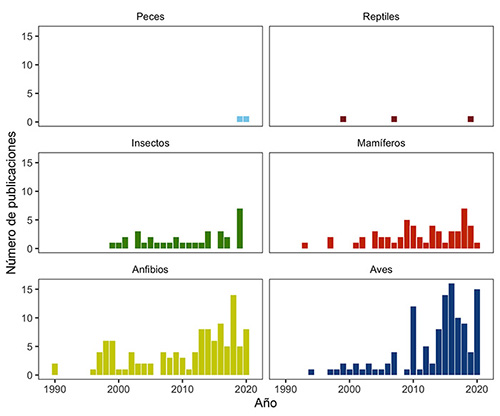
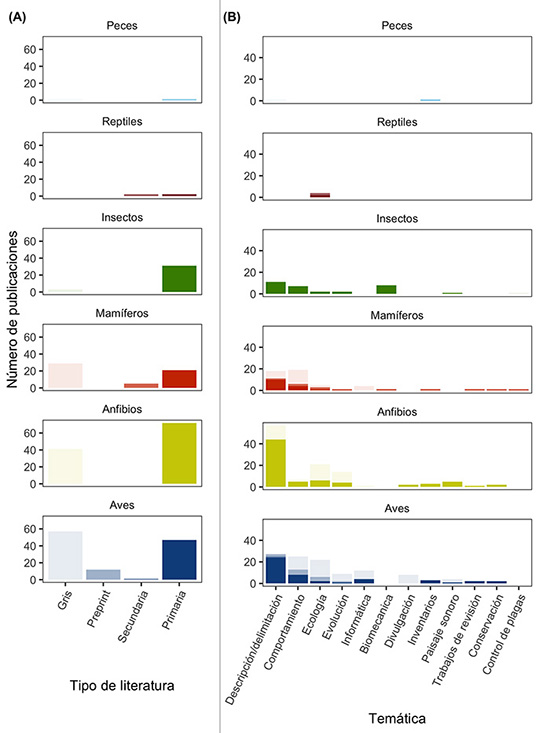
Nuestra revisión arrojó 321 publicaciones. Los grupos taxonómicos con mayor número de estudios en Colombia fueron aves (36.6%) y anfibios (35%), seguidos de mamíferos (17%), insectos (10%), reptiles (1%) y peces (0.6%). En cuanto a la tendencia temporal, antes del año 2000 las publicaciones son relativamente escasas, y a partir del año 2010 se evidencia un notable incremento en el número de publicaciones en casi todos los grupos (Figura 1). El porcentaje de literatura gris es alto en comparación con la literatura primaria en varios grupos (ej. aves, anfibios y mamíferos, Figura 2); la temática más publicada es el uso de acústica para contribuir a la descripción y delimitación de nuevas especies (Figura 2). Además, la región Andina, con el 63%, presentó un mayor número de publicaciones.
Figura 1: Número de estudios de bioacústica en Colombia, por grupo taxonómico, publicados entre 1990 y 2020.
Figura 2: Número de estudios en acústica de fauna en Colombia, segregados por tipo de literatura y temáticas: A, tipo de literatura encontrada para cada grupo; B, temas abordados con mayor frecuencia en estudios acústicos en Colombia.
Insectos. La investigación en acústica de insectos en Colombia es muy limitada. Encontramos 31 resultados, de los cuales 28 son artículos publicados y tres son tesis universitarias (Figura 2A). De esas tesis, dos son de pregrado y una es de doctorado. De los 31 trabajos, 25 están enfocados en el orden Orthoptera, tres Diptera, uno en Homoptera y uno en el orden Coleoptera. Estas publicaciones tratan temas de descripción de caracteres acústicos y descripción de especies usando caracteres de las señales acústicas y biomecánicas (Figura 2B). La mayoría de los trabajos publicados sobre el orden Orthoptera tienen tasas de muestreo por encima de los 100 kHz, debido a que algunas de las familias de este orden se comunican en frecuencias ultrasónicas. Desde 2015 hasta 2020 ha aumentado el número de publicaciones en bioacústica de insectos para Colombia (Figura 1). Las temáticas de los artículos fueron, en su mayoría, biomecánica de las alas de ortópteros, ya que las especies de este grupo producen sonidos mediante estridulación. La segunda temática corresponde a descripciones de caracteres acústicos, tanto para describir una especie nueva como para el estudio de su comportamiento, estudios de ecología, biogeografía y el uso de índices de diversidad acústica (Figura 2A). La región Pacífico presentó el mayor número de trabajos, principalmente en el Parque Nacional Natural Gorgona (Cauca) y en el departamento del Valle del Cauca.
Peces. Los resultados de nuestra búsqueda arrojaron dos publicaciones. De los trabajos encontrados, el primero, corresponde a un trabajo de grado (Muñoz-Duque, 2019), en el que se caracterizan los sonidos emitidos por Prochilodus magdalenae en los departamentos de Antioquia, Córdoba y Santander, y Megaleporinus muyscorum en el departamento de Antioquia.
El segundo trabajo corresponde a un artículo publicado (Ospina-L. et al., 2020), en el cual los autores revisaron y compilaron los registros acústicos de aves, anuros, mamíferos y peces disponibles para el departamento de Santander. Los registros de las dos especies de peces incluidas, corresponden a emisiones de descargas de los órganos eléctricos de peces del orden Gymnotiformes.
Anfibios. A pesar del gran número de especies de anfibios anuros en Colombia, el número de publicaciones en bioacústica es comparativamente bajo, abarcando diferentes aplicaciones en sistemática, taxonomía, ecología, historia natural y monitoreo de poblaciones, entre otros temas (Rivera-Correa et al., en prensa). Encontramos 72 publicaciones y 41 trabajos de grado, desde 1990 a la fecha (Figura 1), que contemplaron el análisis del canto de anuncio en 77 especies (lo que representa el 9.7% de la diversidad de anuros en el país). Estas publicaciones están concentradas en ocho de las 14 familias taxonómicas que se encuentran en Colombia: Aromobatidae, Bufonidae, Centrolenidae, Craugastoridae, Dendrobatidae, Eleutherodactylidae, Hylidae y Leptodactylidae, y en su gran mayoría, los estudios fueron hechos en la región Andina (68%).
Reptiles. En Colombia, los estudios acerca de la producción de señales acústicas en reptiles son muy escasos. En nuestra búsqueda encontramos cuatro resultados para cinco especies, todos describiendo aspectos generales, por ejemplo, aspectos sobre ecología reproductiva que no son necesariamente estudios enfocados en la descripción del uso de señales acústicas per se. De estas investigaciones, dos corresponden a artículos científicos, en los que las especies de estudio fueron el cocodrilo Crocodylus intermedius (Ardila-Robayo et al., 1999) y las tortugas Chelonoidis carbonarius y C. denticulatus (Auffenberg, 1965), en las regiones de la Orinoquia, Caribe y Amazonia respectivamente. Si bien este último estudio fue publicado antes de 1990, previo al rango de tiempo en que nuestra búsqueda hizo énfasis, lo incluimos aquí por ser la única publicación que se conoce para individuos de dichas especies en Colombia. La señal acústica reportada para la tortuga Kinosternon scorpioides corresponde a observaciones personales hechas por M.A. Bedoya-Cañón, citada en un capítulo de libro sobre aspectos generales de anfibios y reptiles en bosque seco tropical del norte de Colombia (Vargas-Salinas et al., 2019). Finalmente, Rueda-Almonacid et al. (2007), describen para Mesoclemmys dahli aspectos generales de su historia natural, incluyendo algunas señales acústicas.
Aves. Encontramos 117 trabajos, de los cuales 49 fueron tesis universitarias, entre pregrado (21), maestría (2) o doctorado (2), y 24 de estas han sido presentadas en congresos (24). Entre 2000-2010, fueron publicadas algunas guías sonoras que abrieron el camino hacia una gran diversidad de enfoques entre 2010-2020. Esa década fue la de mayor producción académica para el grupo, incluyendo trabajos principalmente en taxonomía, usando los caracteres acústicos para la delimitación de especies (Figura 2). Otros trabajos han usado el conocimiento de las vocalizaciones de las aves como herramienta para estudiar comportamiento y ecología, o en inventarios biológicos. Recientemente, algunos trabajos han intentado entender las variaciones del canto en aves en ambientes con ruido antrópico, los parámetros que han generado la diversidad de señales acústicas durante la evolución de las aves o han buscado responder cómo las aves aportan a los paisajes sonoros colombianos. La mayoría de trabajos están concentrados en la región Andina (56%), y muy pocos trabajos en las otras regiones del país (Amazonia, 5%; Caribe, 1.7%; Orinoquia, 1.7%; Pacífico, 0.8%; Sierra Nevada de Santa Marta, 3.4%); al porcentaje restante no se le asignó región, porque no se especificaban las localidades o incluían muchas localidades.
Mamíferos. Encontramos un total de 54 publicaciones: 5 capítulos de libros, 16 artículos, 8 resúmenes de conferencias y 25 trabajos de grado entre 1993 y el 2020. El 70.4% de estas publicaciones fueron hechas en los últimos doce años (Figura 1). Encontramos trabajos sobre acústica para siete de los 14 órdenes de mamíferos que hay en Colombia, de los cuales el orden Primates tuvo el mayor número de publicaciones (22) seguido por Cetacea (14) y Chiroptera (11). Los estudios de bioacústica en mamíferos del país cubren gran variedad de temas, con un mayor número de publicaciones que denominamos Descripción/delimitación de especies. La segunda temática más frecuente fueron los aspectos comportamentales, principalmente para el orden Primates. La mayoría de trabajos se concentraron principalmente en la región Andina (26%) seguido por trabajos realizados ex situ (22%).
Discusión
En general, la bioacústica en Colombia presenta un interés creciente, con un incremento en el número de contribuciones en los últimos diez años, relacionado con su potencial uso como una herramienta que permitirá cuantificar, identificar, monitorear y entender mejor dicha diversidad. La ecoacústica se ha identificado como una herramienta poderosa para estudiar los patrones de diversidad con métodos no invasivos, que además puede aplicarse para estimar el grado de intervención de un ecosistema, mediante el uso de índices de diversidad acústica (Grant, 2014; Riede, 1998; Deichmann, 2018). El incremento en los estudios puede estar relacionado con la mayor asequibilidad y avance en el desarrollo de los equipos y softwares.
Por otra parte, se hace necesario el trabajo colaborativo y multidisciplinario, independientemente de los grupos taxonómicos de interés. Esto permitirá construir un consenso en las metodologías, al mismo tiempo que se desarrollan o se prueban herramientas de procesamiento de audio de código abierto, y se llenan vacíos sobre la precisión, la transferibilidad y las limitaciones de muchos métodos analíticos (Greenhalgh et al., 2020). A continuación, presentamos una discusión más detallada de los resultados para cada uno de los grupos.
Insectos. Colombia presenta una alta diversidad y endemismo de insectos, que se encuentran distribuidos tanto en ecosistemas dulceacuícolas como terrestres (Samways, 2005; Kattán et al., 2004). Sin embargo, a pesar de esta diversidad, el conocimiento de la acústica de este grupo es muy limitado. De 28 órdenes de insectos (Amat-García & Fernández, 2011), al menos 10 presentan comunicación acústica (Sanborn, 2008). En Colombia sólo se ha estudiado la acústica de cuatro órdenes, aunque la mayoría de estos estudios se concentran sólo en el orden Orthoptera.
El escaso conocimiento sobre acústica de insectos que encontramos es comparable con la investigación general sobre insectos, con un marcado vacío de información en los trópicos (Basset & Lamarre, 2019). La implementación de técnicas de bioacústica en futuros estudios puede contribuir a cerrar la brecha de conocimiento acerca de especies tropicales. Por ejemplo, el monitoreo acústico en conjunto con identificación automatizada ha sido evaluado en algunos grupos de insectos (Ganchev & Potamitis, 2007; Aide et al., 2013), y parece ser una herramienta potencial para conservar e identificar los patrones de diversidad acústica en respuesta a la actividad humana (Riede, 1998; Grant, 2014). Además de su uso en conservación, también se pueden implementar futuros estudios de bioacústica para la identificación de especies crípticas (Araki et al., 2009) y especies con importancia agrícola en el contexto local (Gutiérrez et al., 2010), así como para ecosistemas dulceacuícolas, en los que se destacan por la producción de sonidos los coleópteros y hemípteros, pero también algunos odonatos y tricópteros (Desjonquères et al., 2020).
Una aplicación de este tipo de estudios en Colombia se relaciona con las enfermedades transmitidas por vectores, uno de los problemas más importantes en salud pública (Jaimes-Dueñez et al., 2017). Estudios previos han reportado que el sonido tiene un rol importante en el comportamiento de cortejo de insectos hematófagos, como los mosquitos, moscas de arena, triatominos y moscas tsetsé (Li et al., 2012; Vigoder et al., 2013). Los caracteres de las señales acústicas son importantes en el aislamiento de especies y en el flujo genético (Araki, et al., 2009; de Souza et al., 2004), por lo cual el estudio de los mecanismos de comunicación acústica de los insectos vectores de enfermedades en los órdenes Diptera y Hemiptera puede ser de gran utilidad para control biológico (Vigoder et al., 2013; Li et al., 2012). Hasta el momento, en Colombia no se han realizado estudios sobre bioacústica de insectos en ecosistemas dulceacuícolas, y este tipo de investigaciones pueden ser de gran importancia para evaluar el estado de conservación de cuerpos de agua dulce (Greenhalgh et al., 2020). Abordar este tipo de estudios es muy relevante, ya que los insectos aportan significativamente con sus señales al paisaje sonoro tropical (Aide et al., 2017).
Peces. A escala global, se han reportado más de 700 especies de peces que producen sonidos (Kaatz & Stewart, 2012), de los cuales al menos 80 son peces de agua dulce (Greenhalgh et al., 2020). Sin embargo, este número es probablemente mayor, y se estima que un tercio del total de las especies de peces (34 300 especies www.fishbase.org) tienen la capacidad de emitir algún tipo de señal acústica (Ladich & Bass, 2011). Generalmente, los sonidos producidos por peces son específicos de cada especie y están asociados con comportamientos y contextos particulares (Amorim et al., 2015), por lo que pueden usarse como una etiqueta acústica natural para detectar, localizar y monitorear la presencia de distintas especies (Luczkovich et al., 2008; Širović et al., 2009; Picciulin et al., 2013).
En Colombia se conocen aproximadamente 4200 especies de peces, cifra cercana al 12% de la riqueza de peces mundial; alrededor de 2600 especies de la ictiofauna colombiana pueden ser consideradas marinas o, al menos, habitantes de los ecosistemas resultantes de la mezcla de las aguas dulces y saladas (Acero & Polanco, 2017). Así mismo, Colombia es uno de los países más diversos del mundo en cuanto a fauna acuática continental o dulceacuícola se refiere (Lasso et al., 2017) ocupando el segundo lugar a nivel mundial, con 1572 especies, de las cuales el 25% (392) son endémicas y el 4,8% se encuentra bajo alguna categoría de amenaza (DoNascimento et al., 2019). Considerando lo anterior, el potencial de estudios de ecoacústica aplicada a la fauna íctica del país es inmenso.
Desde hace años el conocimiento tradicional de los pescadores artesanales en Colombia ha reconocido la existencia de peces soníferos en las cuencas más importantes de nuestro país, tales como el Magdalena, Atrato, Sinú, Amazonia y Orinoquia (TNC, datos no publicados), e incluso existen algunas menciones en la literatura científica sobre la producción de sonidos en ejemplares macho de Prochilodus magdalenae, como un indicativo de la madurez gonadal y el acercamiento de la época del desove (Dahl et al., 1963), y a comportamientos asociados a la reproducción de varias especies del género Prochilodus (Flórez, 1985). Más recientemente, se reportó la producción de sonidos (ronquidos) en Prochilodus reticulatus como un criterio de madurez de machos con fines de reproducción en cautiverio (Quintero-García, 2016) y a la producción de sonidos en especies marinas de la familia Sciaenidae (Tavera, 2002; Von & Grajales, 2007; de la Rosa, 2018). No obstante, sólo encontramos un trabajo sobre bioacústica en peces de Colombia (Muñoz-Duque, 2019), así como la posibilidad de usar herramientas de medición acústica para el estudio de peces de manera alternativa a través de la grabación se sus señales eléctricas (Ospina-L et al., 2020).
La falta de desarrollo en este campo puede deberse al elevado costo de los hidrófonos para la toma de datos y a la falta de reconocimiento de las posibles aplicaciones de este tipo de estudios en el país. Sin embargo, el costo de las grabadoras de sonidos e hidrófonos ha disminuido sustancialmente en años recientes y, además, la tecnología necesaria para almacenar y analizar datos acústicos está mejorando continuamente (Deichmann et al., 2018). A pesar de esto, el alcance de aplicación del monitoreo acústico pasivo (MAP) sigue estando limitado por la poca disponibilidad de bibliotecas con sonidos de referencia y herramientas de procesamiento de audio (Greenhalgh et al., 2020).
Se ha reconocido a nivel mundial que la hidroacústica puede ser una gran herramienta no invasiva para el monitoreo de la biodiversidad acuática, mostrándo que el empleo del MAP es una técnica que puede usarse para la identificación e inventario de especies y también para la evaluación de procesos, tanto de las especies acuáticas como de los ecosistemas en que habitan (Desjonquères et al., 2020).
De este modo, la ecoacústica puede ser usada en ambientes marinos y continentales para diversos estudios, ecológicos, evolutivos, comportamentales y de biodiversidad, e incluso con fines de manejo de las pesquerías, algunas veces relacionados con la conservación de las especies o hábitats involucrados. Un ejemplo de esta aproximación en sistemas acuáticos continentales es el empleo de la ecoacústica para identificar y caracterizar las áreas de reproducción de peces potamódromos de la cuenca del río Magdalena, y de este modo priorizar dichos hábitats para la conservación de estas especies ante el desarrollo hidroeléctrico en la cuenca (Muñoz-Duque, 2019). La información acústica también se ha utilizado en el monitoreo de peces en grandes sistemas dulceacuícolas, como el río Amazonas (Anderson et al., 2008; Borie et al., 2014; Godinho et al., 2017). Esta información puede ser clave para la conservación o manejo de las pesquerías de que producen sonidos, ya que puede ser posible identificar temporadas de eventos de reproducción y localizar con alta precisión áreas de desove (Rountree et al., 2006; Mann et al., 2008; Casaretto et al., 2014), e inclusive estimar y monitorear la densidad, abundancia y biomasa de stocks de peces agregados en función a eventos de desove durante periodos con tasas estables de producción de sonidos (Gannon & Gannon, 2009; Širović et al., 2009), entre otros datos de la biología reproductiva (Godinho et al., 2017).
Anfibios. En la actualidad, en Colombia se conocen 850 especies de anfibios, 790 de las cuales son anuros (ranas y sapos); las 60 especies restantes pertenecen a los órdenes Caudata (salamandras) y Gymnophiona (cecilias) (http://www.batrachia.com). Con esta riqueza de especies, Colombia es considerado el segundo país en el planeta con mayor biodiversidad en esta clase de vertebrados. Entre los diversos y fascinantes aspectos de la biología de los anfibios están sus sistemas de comunicación (Gerhardt & Huber, 2002; Wells, 2007; Starnberger et al., 2014). Las vocalizaciones, particularmente el canto de anuncio, son el principal y más estudiado mecanismo de comunicación entre los anfibios anuros. Este tipo de canto es usualmente emitido por machos adultos, y se le ha atribuido funciones relacionadas a la atracción de hembras y demarcación de sitios de canto (Duellman & Trueb, 1994; Wells, 2007; Köhler et al., 2017).
La familia Dendrobatidae es la más estudiada desde una perspectiva acústica, lo cual puede estar relacionado con que ha sido una fuente de numerosas investigaciones desde la década de 1970. En Colombia, han sido estudiadas 26 de las 94 especies (28%), principalmente con enfoque taxonómico (Twomey & Brown, 2009; Amézquita et al., 2013; Márquez et al., 2017; Marin et al., 2018), de comportamiento social, biología evolutiva (Rojas et al., 2006; Erdtmann & Amézquita, 2011; Medina et al., 2013) y en ecoacústica (Vargas-Salinas & Amézquita, 2013a, b; Vargas-Salinas et al., 2014). La segunda familia con un mayor análisis de las señales acústicas es la más diversa en Colombia, Craugastoridae, de la que se conocen en el país 264 especies. No obstante, sólo 18 especies (el 6.8%) han sido evaluadas acústicamente. Los estudios en Colombia que incluyen análisis de señales acústicas en especies de esta familia se han centrado en describir sus cantos de anuncio (Bernal et al., 2004; Romero-García et al., 2015; Ríos-Soto y Ospina-L. 2018; Duarte-Marín & Arango-Ospina, 2019) o en utilizar atributos de dichas señales como evidencia en la delimitación de nuevas especies (Ospina-Sarria et al., 2015; Rivera-Correa et al., 2016; Ospina-Sarria & Angarita-Sierra, 2020). El 72% de las investigaciones en señales acústicas de los anuros de Colombia se ha desarrollado en especies con distribución andina. Resultados similares fueron obtenidos por Rivera-Correa et al., (en prensa), quienes asociaron este patrón con la mayor riqueza de especies en esta región geográfica y con que la mayoría de los centros de investigación y universidades que estudian la biología del comportamiento y la historia natural de los anuros en el país están establecidas en esta región. Adicionalmente, un hallazgo llamativo es que 37 de las 77 especies estudiadas acústicamente en estos últimos 30 años, se encuentran en alguna categoría de amenaza, de acuerdo con los criterios de la IUCN (2020). Esto nos revela un desafio importante a la hora de establecer estaciones de monitoreo pasivo particularmente en un grupo altamente amenazado como lo es los anfibios de Colombia.
Nuestros resultados sugieren la necesidad de unir esfuerzos que integren las señales acústicas como sistema de estudio, para incrementar el conocimiento de la diversidad de anuros y como estrategia para abordar múltiples preguntas en biología del comportamiento, bioacústica, ecoacústica y monitoreo de poblaciones.
Reptiles. Se conoce que la producción de señales acústicas en reptiles ha evolucionado en cocodrilos, tortugas, lagartos y en menor medida en serpientes (Frankenberg & Werner, 1992; Chen & Wiens, 2020). También está establecido que la mayoría de reptiles tienen cierta capacidad de percibir sonidos, pero sólo en algunos grupos se ha comprobado comunicación acústica entre conespecíficos (Dooling et al., 2000, Rohtla et al., 2019). En lo referente a Colombia, el segundo país del planeta con mayor diversidad de reptiles (> 600 especies; The Reptile Database, http://www.reptile-database.org), los estudios acerca de la producción de señales acústicas en estos vertebrados son muy escasos. La producción de señales acústicas se ha registrado por lo menos para 26 especies de reptiles presentes en Colombia; 21 de ellas son nativas y cinco son introducidas; sin embargo, estudios hechos directamente en Colombia sobre esta temática se limitan a una especie de cocodrilo (Crocodylus intermedius) y cuatro especies de tortugas (Chelonoidis carbonarius, C. denticulatus, Kinosternon scorpioides, Mesoclemmys dahli).
En Crocodylus intermedius, se han reportado señales acústicas producidas por los neonatos antes de la eclosión de los huevos (Ardila-Robayo et al., 1999). Dichas señales simulan un “pugido” con una duración de aproximadamente un segundo. En relación a las tortugas, Auffenberg (1965) reportó que machos de Chelonoidis carbonarius y Chelonoidis denticulatus producen sonidos (chirridos) cuando montan a la hembra. En Kinosternon scorpioides, se reportó un bramido emitido por uno de varios individuos mantenidos en cautiverio (observaciones personales por M.A. Bedoya-Cañón, citada por Vargas-Salinas et al., 2019). Finalmente, se reportó que machos adultos de Mesoclemmys dahli (especie endémica a Colombia), suelen restregar su cabeza contra objetos sumergidos en el agua, y de esta forma, producen ruidos que aparentemente tienen como función delimitar su territorio o atraer a las hembras durante la temporada de apareamiento (Rueda-Almonacid et al., 2007).
Aún nos falta mucho por conocer en diversos aspectos relacionados al uso de señales acústicas en reptiles de Colombia. Por ejemplo, es común que haya variación geográfica intraespecífica en características de señales de comunicación en animales (Wilczynski & Ryan, 1999; Velásquez, 2014; Morton, 2017), lo que hace importante documentar la presencia y grado de variabilidad en reptiles de Colombia, y establecer su relación con características del hábitat, interacciones bióticas y si eventualmente podría promover procesos de aislamiento reproductivo entre poblaciones. Por otro lado, individuos adultos de especies de tortugas, lagartos y serpientes tienen capacidad auditiva que les permite detectar potenciales depredadores (Dooling et al., 2000; Christensen-Dalsgaard & Manley, 2005; Christensen-Dalsgaard et al., 2012; Martin et al., 2012; Cantwell & Forrest, 2013; Lavender et al., 2014; Curlis et al., 2016). Esta capacidad auditiva posiblemente esté difundida en reptiles de Colombia (ver, p. ej., Amphisbaena alba,Gans & Wever, 1972). Teniendo en cuenta la gran variedad de reptiles en Colombia, existe un gran potencial de investigación que permita ampliar nuestro conocimiento sobre los procesos que han promovido la evolución de señales acústicas en este grupo y su rol en interacciones ecológicas y comportamentales a nivel intra e interespecífico.
Aves. Tal vez la primera compilación que describe los sonidos de las aves de Colombia fue la guía de aves de Hilty & Brown (1986) . En sus recuentos de las especies, hay descripciones onomatopéyicas muy detalladas que permitieron a muchos observadores identificar e incorporar el conocimiento de los cantos en sus observaciones. Sin embargo, en algunas publicaciones previas también habían sido descritos onomatopoyéticamente algunos sonidos (ver Olivares 1964). La grabación direccional de sonidos (Parker 1991) permitió conocer muchos aspectos desconocidos de la avifauna neotropical. Por ejemplo, el trabajo de Ted Parker III entre 1970 y 1990 fue uno de los más importantes e influyentes para muchos de los sonidistas que han captado esta otra dimensión de la biodiversidad neotropical (Robbins et al., 1997), permitiendo predecir el descubrimiento de varios taxones nuevos para la ciencia a partir de las grabaciones que él compiló hace varias décadas (Schulenberg & Parker, 1997; Remsen et al., 1997). Posteriormente, sonidistas colombianos fortalecieron la toma en campo de sonidos y su almacenaje organizado en repositorios, como la Colección de Sonidos Ambientales (o Banco de Sonidos Animales, en su momento). En particular, Mauricio Álvarez-Rebolledo promovió la grabación de sonidos como método complementario para inventarios de biodiversidad en Colombia, a partir de cursos en campo desarrollados en distintas regiones de Colombia. Posteriormente, se generaron piezas de audio para la divulgación de los sonidos de las aves de los departamentos de Caldas (Álvarez-R. & Córdoba-Córdoba, 2002), Valle del Cauca (Álvarez-R. & Córdoba-Córdoba, 2002), Norte de Santander (Córdoba-Córdoba & Álvarez-R., 2003), la Sierra Nevada de Santa Marta (Strewe et al., 2004), el Santuario de Fauna y Flora de Iguaque ( Álvarez-R. et al., 2007), y de los Andes colombianos (Álvarez-R. et al., 2007). Por otro lado, unos años después, Boesman (2012) recopiló más de 5000 sonidos de 1644 especies de aves de Colombia.
La delimitación taxonómica de varios grupos de aves ha sido complementada a partir de integrar la acústica como herramienta para entender la avifauna tropical (Isler et al., 1998). Este tipo de estudios siguen vigentes en la actualidad, resaltando la importancia de seguir grabando y analizando los sonidos de aves colombianas. Esto indica que aún tenemos que seguir descubriendo cómo son las señales acústicas de las aves colombianas, y cómo varían los sonidos de diferentes poblaciones (Cuervo et al., 2014; Cadena et al., 2015). Sin embargo, de manera simultánea, a medida que se toman sonidos en campo asociados a buena información, podríamos ver un incremento en trabajos de ecología (Negret et al., 2015; Sánchez-Guzmán & Losada-Prado, 2016), comportamiento (Dorado-Correa et al., 2016; Cárdenas-Posada et al., 2018) y conservación (Laverde-R. & Cadena, 2014; Negret & Laverde-R., 2015). Dicha información es primordial para el desarrollo de trabajos sobre biología evolutiva (Caro et al., 2013) y herramientas de informática acústica de aves colombianas (Tobón & Posada, 2015).
De los 117 trabajos encontrados, la mayoría corresponden a literatura gris en forma de tesis de pregrado (21), maestría (2) o doctorado (2), algunas compartidas en simposios dentro de congresos (24). Lo que resalta que el mayor reto es fometar la publicación de los resultados de las investigaciones
Durante las últimas décadas, se ha incrementado el interés por el conocimiento de las vocalizaciones de las aves en varios contextos. Sin embargo, cuando hablamos de bioacústica, esta disciplina incluye no sólo la señal (i. e., el canto, llamado u otro tipo de sonido producido por el ave); también incluye la producción y la percepción del sonido; por ejemplo, de las más de 1900 especies registradas en el territorio nacional, no conocemos cómo escuchan, qué escuchan o cómo la audición de los depredadores pudo haber influido en la evolución de las características acústicas de sus presas. Adicionalmente, pocos trabajos han estudiado la estructura de las siringes, especialmente en los suboscines, la cual es muy interesante, porque su canto no es aprendido. Al parecer, la estructura de su siringe es la que determina la estructura del canto (García et al., 2017). Entender la relación entre siringe y canto puede ayudarnos a entender mejor cómo ha evolucionado el canto en este grupo tan diverso.
Por otro lado, es necesario estudiar los patrones de producción de canto a diferentes escalas, porque puede darnos información sobre cómo los cambios en el clima están afectando los ciclos de las poblaciones de aves. Los patrones de actividad diarios y anuales pueden ser afectados por variaciones climáticas drásticas a gran escala (Pérez-Granados et al., 2019; Pérez-Granados et al., 2020).
Finalmente, la socialización del conocimiento sobre acústica de aves, y otros grupos, requiere seguir fomentando la obtención de grabaciones de alta calidad que permitan extraer variables necesarias para estudios en bioacústica. Sin embargo, con el desarrollo de MAP, el desafío de almacenamiento, visualización y análisis sigue manteniéndose (Deichmann et al., 2018). En este sentido, plataformas modulares (ej. Kass et al., 2018) que integren repositorios de sonidos direccionales y datos provenientes de MAP, así como métodos de análisis novedosos (Ovaskainen et al., 2018; LeBien et al., 2020; Zhong et al., 2020) serán un avance en la estructuración investigativa de la acústica de aves y otros grupos en Colombia.
Mamíferos. Los mamíferos son un grupo con una alta heterogeneidad en su anatomía, biología, ecología y comportamiento (Tirira, 2007). A pesar de esta diversidad, la producción académica sobre acústica de mamíferos en Colombia no es muy extensa y se encuentra más enfocada en unos órdenes que otros.
Para el orden Cetácea, los estudios en acústica han tomado gran relevancia a nivel global, principalmente porque existen dificultades inherentes en estudiarlos y entender los efectos de las actividades humanas sobre estos animales; la aplicación tecnológica es en una herramienta necesaria para su estudio (Gervaise et al., 2007). El desarrollo de grabadoras autónomas fijas de sonido subacuático permite grabar datos acústicos del fondo del océano por meses, permitiendo realizar grabaciones en sitios donde la detección de estos animales es poco frecuente (Sousa-Lima et al., 2013). El uso de MAP en mamíferos acuáticos es un método efectivo para identificar qué especies están presentes en un lugar específico (Heimlich et al., 2005), rastrear individuos (Sousa-Lima & Clark, 2008) y determinar patrones de distribución (Mellinger et al., 2004), entre otros aspectos. En Colombia, se han realizado estudios que describen el repertorio vocal de especies como Sotalia fluviatilis y S. guianensis en el Golfo de Morrosquillo (Bernasconi et al., 2005; Bernasconi et al. , 2006), de Inia geoffrensis y S. fluviatilis en los ríos Orinoco y Amazonas (Díaz-Granados & Trujillo, 2002), y de ballenas jorobadas en el golfo de Tribugá (Perazio et al., 2018).
Para el orden Primates, la comunicación acústica es especialmente importante, ya que la usan frecuentemente para mediar diversas interacciones comportamentales (Barbosa et al., 2018). En Colombia existen 13 géneros de primates y todos ellos emiten algún tipo de vocalización (Hernández & Zerda-Ordoñez, 2006). Dentro de los trabajos publicados en acústica de primates encontramos descripciones del repertorio acústico de varias especies, por lo general relacionadas con aspectos de comportamiento. Especies como Saguinus leucopus, S. oedipus, Lagothrix lagothricha y Ateles hybridus cuentan con descripciones de su repertorio acústico, pero, aún hay muchas especies que no cuentan con ningún tipo de aproximación acústica. Contar con descripciones básicas del repertorio acústico de las especies de primates en Colombia es relevante, y las herramientas acústicas tienen un gran potencial. Por ejemplo, las vocalizaciones de largo alcance que emiten algunas especies de primates son útiles para incrementar la detección de especies en campo, así como para obtener datos poblacionales a partir del uso de playbacks (Gestich et al., 2017; Barbosa et al., 2018).
El almacenamiento de grabaciones en repositorios disponibles es fundamental a la hora de impulsar la investigación acústica de mamíferos en Colombia (Lozano-Flórez et al., 2021). En el caso de murciélagos, la creación de librerías que almacenan señales acústicas de ecolocalización permiten la comparación y la confirmación en la identificación de especies (Zamora et al., 2020). Colombia es el segundo país con mayor diversidad de especies de murciélagos en el mundo; sin embargo, los estudios en acústica de murciélagos son limitados a seis publicaciones en revistas científicas y cinco trabajos de grado. Si bien es cierto que realizar grabaciones de referencia no es sencillo, especialmente en países megadiversos como Colombia, las aplicaciones potenciales son innumerables. A través de métodos bioacústicos es posible cuantificar y monitorear especies de murciélagos que no son fácilmente detectables a través de métodos tradicionales. Por otro lado, el uso de herramientas acústicas en estudios taxonómicos (Rodríguez & Mora, 2006), ecológicos (Rogers et al., 2006) y comportamentales (Meyer et al., 2004) es cada vez más común. Además, los murciélagos son indicadores ideales para entender cambios a causa de actividades antrópicas, y por ende, los monitoreos acústicos sistemáticos pueden revelar cambios ambientales y disturbios ecológicos a largo plazo (Zamora et al., 2020).
Los monitoreos acústicos tienen un gran potencial a futuro, no solo porque con los años la tecnología se ha hecho más asequible y maniobrable (los equipos cada vez son más fáciles de instalar y transportar), sino también porque muchas especies de mamíferos emiten señales sonoras continuamente y las grabaciones acústicas pueden brindar una nueva posibilidad de su estudio. Sin embargo, para esto es necesario contar con trabajos de descripciones acústicas y con grabaciones de referencia en Colombia para el desarrollo de estudios de monitoreo. Los resultados que encontramos para los órdenes Carnívora, Sirenia, Artiodactyla y Rodentia fueron muy escasos; esto evidencia un fuerte vacío en el conocimiento en órdenes con un gran potencial de trabajo (Lozano-Flórez et al., 2021). El comportamiento acústico puede proporcionar señales filogenéticas (Peters & Tonking-Leyhausen, 1999; Cap et al., 2008), estimar abundancias (Thompson et al., 2010), apoyar herramientas de reconocimiento individual (Sousa-Lima et al., 2008; Della Libera et al., 2015; Carlson et al., 2020), y por ende, brindar información sobre las poblaciones (Umeed et al., 2018) en especies difíciles de capturar o en categoría de peligro (p. ej., manatíes) en las que las herramientas acústicas tienen una ventaja más, al ser métodos no invasivos.
Consideraciones finales
En Colombia, al ser un país con una diversidad tan alta, el potencial de la acústica como campo de investigación es inmenso y su estudio en el país amplía las posibilidades de responder preguntas en otras áreas como la conservación, el comportamiento, la evolución y la ecología. Adicionalmente, el monitoreo acústico es una herramienta que puede ayudar a resolver respuestas ecológicas ante la degradación de los hábitats y ecosistemas naturales que cada día experimentan cambios debido al incremento acelerado de las actividades antrópicas (Llusia et al., 2013).
En general, nuestros resultados muestran que los estudios en bioacústica en el país aun son muy escasos, con baja representatividad taxonómica y regional. A esto se suma una baja tasa de publicación de los trabajos desarrollados en los procesos de formación académica, siendo de acceso limitado y con poco impacto y replicabilidad. Por lo tanto, uno de los retos principales es diseñar estrategias para incentivar la publicación de estos trabajos y la disponibilización de sus repositorios de sonidos.
Adicionalmente, es necesario fortalecer y alimentar las colecciones de sonidos del país, para aumentar la disponibilidad de grabaciones de referencia de todos los grupos taxonómicos. Esto conlleva la necesidad de generar protocolos de construcción de repositorios de referencia, de control de calidad y de su uso y análisis. Esperamos que este trabajo incentive la investigación en acústica en el país, sobre todo en aquellos grupos con vacíos de información. Creemos que la Red de Ecoacústica Colombiana juega un papel muy importante como eje para fortalecer alianzas y fomentar el trabajo multidisciplinario y colaborativo sobre esta temática en el país.