Resumen
Empleando modelos de ocupación, se evaluaron cinco variables (cuatro del paisaje y una del paisaje acústico) como predictoras de la ocupación del hábitat por parte de diez anuros neotropicales. Se reportó por primera vez una variable que describe el uso del espectro acústico como un predictor en la ocupación de anuros. Se encontró que la ocupación de las especies estuvo asociada con al menos una de las variables evaluadas, y tres especies presentaron ocupaciones asociadas con el uso del espectro acústico. Los resultados muestran que la cobertura de bosque, la topografía y el uso del espectro acústico son predictores de la ocupación de anuros neotropicales. Este estudio destaca el potencial de incorporar ecoacústica y la caracterización del paisaje en un marco metodológico único, para predecir patrones poblacionales.
Palabras clave:
Comunicación acústica, Ocupación de anuros, Ocupación Espectral, Paisaje acústico..Abstract
Using occupancy models, we tested five variables (four landscape-related and one soundscape-related) as predictors of the occupation of ten neotropical anurans. We report for the first time a variable that describes the use of the acoustic spectrum as a predictor of anuran occupation. We found that occupation was associated with at least one of the tested environmental variables, and that three species presented occupancies associated with the use of the acoustic spectrum. Our results show that vegetation cover, topography, and use of the acoustic spectrum are predictors of neotropical anuran occurrence. This study highlights the benefits of incorporating ecoacoustics and landscape characterization into a single methodological framework, to predict population patterns.
Keywords:
Acoustic communication, Anuran Occupancy, Landscape, Soundscape, Spectral..Introducción
La presencia de especies está asociada a variables ambientales que condicionan sus hábitats, y para entender esta asociación es necesario encontrar variables que no solo describan el hábitat, sino que también se relacionen con requerimientos ecológicos de cada especie (Mackenzie et al., 2006). Habitualmente, las descripciones de hábitats incluyen factores físicos relacionados con el microhábitat, el paisaje y el clima, los cuales afectan parámetros poblaciones, como la presencia y abundancia de especies (Davis et al., 2017; Gorosito et al., 2018; Todd et al., 2018). Adicionalmente, factores relacionados con la composición de sonidos provenientes de fuentes bióticas, abióticas y humanas (i.e., paisaje acústico) han alcanzado popularidad en la caracterización de hábitats, porque los sonidos no solo hacen parte de la comunicación acústica en una gran cantidad de especies, sino que también reflejan estados ecológicos y cambios a través del paisaje (Gasc et al., 2013). No obstante, son pocos los estudios que han encontrado un efecto de este tipo de factores sobre parámetros poblacionales de las especies (Ghadiri et al., 2019; Vincelette et al., 2019; Sebastianelli et al., 2020).
Los factores asociados al paisaje acústico pueden afectar la presencia de especies con comunicación acústica, debido a que este tipo de comunicación es altamente relevante en muchos vertebrados e invertebrados, ya que los sonidos además de proporcionar información sobre condiciones específicas de los hábitats, también están involucrados en comportamientos relacionados con la aptitud biológica de las especies (Marler & Slabbekoorn, 2004; Mullet et al., 2017). Las señales acústicas emitidas por animales son definidas por variables intrínsecas y extrínsecas de estos, puesto que condiciones morfológicas y fisiológicas determinan las características físicas de sus señales (Fitch & Hauser, 2002), y factores ambientales representan fuerzas selectivas que favorecen o desfavorecen las propiedades físicas de las señales (Carvajal-Castro & Vargas-Salinas, 2016; Graham et al., 2017). Las especies se pueden adaptar acústicamente a los hábitats, pero esta capacidad es limitada por su morfología y fisiología, por lo cual no pueden adaptarse acústicamente a cualquier hábitat; así que los factores ambientales propician la selección de hábitats con condiciones físicas que permitan y optimicen su comunicación (Herrera-montes & Aide, 2011; McClure et al., 2013; Mullet et al., 2017; De Camargo Barbosa et al., 2020). Adicionalmente, la selección de los hábitats también puede estar relacionada con sonidos provenientes de eventos geofísicos (i. e. geofonía) que proporcionan información para identificar recursos (p. ej., corrientes de agua) o evitar ambientes que disminuyen la capacidad de comunicación (Ghadiri et al., 2019; Vincelette et al., 2019; Sebastianelli et al., 2020). Por eso es de esperar que la presencia de especies con comunicación acústica no solo esté relacionada con factores del microhábitat, sino también con factores del paisaje acústico.
Uno de los factores asociados al paisaje acústico es el espacio acústico, el cual es el espacio físico donde ocurren los sonidos, definido en tres dimensiones: frecuencia, espacio, y tiempo (Greenfield, 1983). Este es un recurso ecológico y, al igual que otros recursos, es limitado por el número de individuos que lo utilizan dentro de un hábitat, o en este caso específico por el número de sonidos provenientes de fuentes bióticas y abióticas (Schmidt et al., 2012); las especies pueden competir por el recurso, dando lugar, eventualmente, a una partición del mismo (Aide et al., 2017; Estrela et al., 2020; Wilson et al., 2020). El uso del espacio acústico puede ser medido a través de la ocupación del espectro acústico (OE) (Xue et al., 2013), una medida que incorpora información de la dimensión espectral y temporal del espacio acústico, interpretada como una generalización del índice NP (number of peaks, Gasc et al., 2013), dónde no sólo se suman el número de picos (i. e., el número de bandas de frecuencia usadas), sino su contribución al espectro (i. e., ancho de cada banda de frecuencias). De acuerdo a lo anterior surge la hipótesis de que la variable OE está asociada con la presencia de especies, ya que indica que tan hostil es un ambiente para la comunicación acústica, se ha encontrado que la hostilidad acústica ocasiona cambios comportamentales de individuos y afecta la presencia de especies con este tipo de comunicación (De Camargo Barbosa et al., 2020; Sebastianelli et al., 2020).
Nuestro estudio propone a la OE como una variable ambiental determinante en la presencia de especies con comunicación acústica. Seleccionamos como grupo de estudio a los anuros para poner a prueba esta variable, ya que aproximadamente el 70 % de sus especies se comunican acústicamente (Pereyra et al., 2016), presentan señales acústicas bien definidas (Köhler et al., 2017), y se ha evidenciado que sus llamados son susceptibles a condiciones ambientales y a características del paisaje acústico (Bosch & De la Riva, 2004; Lee et al., 2017; Zhao et al., 2017), pudiendo los machos seleccionar hábitats acústicamente adecuados para su comunicación (Cunha & Napoli, 2016). Debido a que se ha documentado ampliamente que las variables del paisaje están asociadas con la ocupación de estos organismos (Strauß et al., 2012; Rivera & Folt, 2018; Westgate et al., 2018; Cassel et al., 2019), evaluamos el efecto de la ocupación espectral en la presencia de anuros mediante modelos estadísticos que incluyen variables del paisaje, específicamente variables que describen la cobertura vegetal y la topografía, lo cual nos permitió tener una dimensión ambiental amplia asociada a la presencia de anuros neotropicales, que incluye diferentes factores del paisaje y el espacio espectral.
Materiales y métodos
Área de estudio y sitios de muestreo
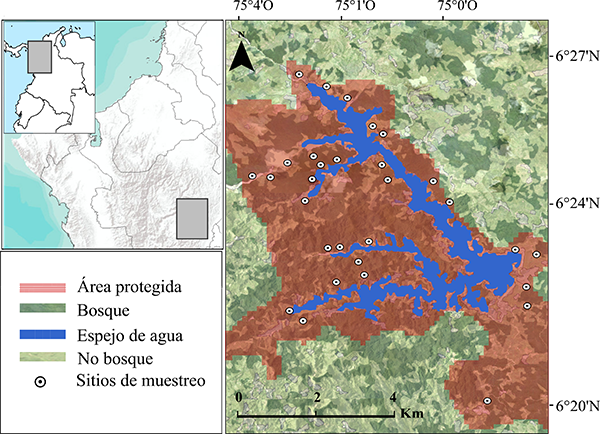
El área de estudio corresponde al área protegida de la Central hidroeléctrica Jaguas (06°24ʹ16ʺ N - 075°01ʹ58ʺ O), localizada en el flanco oriental de la Cordillera Central en el departamento de Antioquia, Colombia (¡Error! Referencia de hipervínculo no válida.). Esta área abarca cerca de 40 km2, presenta un relieve montañoso que comprende elevaciones entre los 1100 a 1300 m s.n.m, rico en microcuencas hidrográficas con corrientes permanentes que fluyen hasta a un espejo de agua de 10.6 km2. La temperatura de la zona oscila entre 18 y 24 °C, con precipitaciones promedio anuales de 2000 a 4000 mm. El área corresponde a la zona de vida bosque húmedo premontano (Holdridge, 1967), con alturas de dosel entre los 15 y 30 m. Algunas zonas presentan intervención antrópica causada por actividades como la agricultura, la ganadería, vivienda y minería ilegal. En el área existen fuentes esporádicas de antropofonía derivadas de actividades mineras ilegales, tránsito vehicular y pesca recreativa. En general, la geofonía es dominada por el sonido de pequeñas quebradas con corriente continua.
Seleccionamos como unidades de muestreo 30 puntos aleatorios asociados a microcuencas, para maximizar la detección de anuros, considerando que la mayoría de las especies en la zona han sido asociadas a pequeños cuerpos de agua. Para mantener la independencia espacial entre sitios y no presentar detecciones de un mismo individuo en dos sitios, mantuvimos una distancia mínima de 300 m entre estos, distancia mayor a la reportada en patrones de movimiento de individuos (por día) en la mayoría de las especies de anuros (Beck et al., 2017; Groff et al., 2017) y superior al rango máximo de detección de grabadoras en bosques neotropicales (Campos-Cerqueira & Aide, 2016).
Figura 1: Área de estudio del hábitat y espectro acústico de anuros, en la vertiente oriental del norte de la Cordillera Central en Antioquia, Colombia.
Monitoreo acústico pasivo y detección de especies
En el periodo comprendido entre mayo y julio del 2017 realizamos en cada uno de los sitios de muestreo un monitoreo acústico pasivo con grabadoras Song Meter SM4 (Wildlife Acoustics, Inc.). En cada sitio se instaló una grabadora a 1.50 m de altura, la cual fue programada para grabar un minuto cada 15 minutos, durante 24 horas, a 16 bits, con ambos canales, y una tasa de muestreo de 24 kHz.
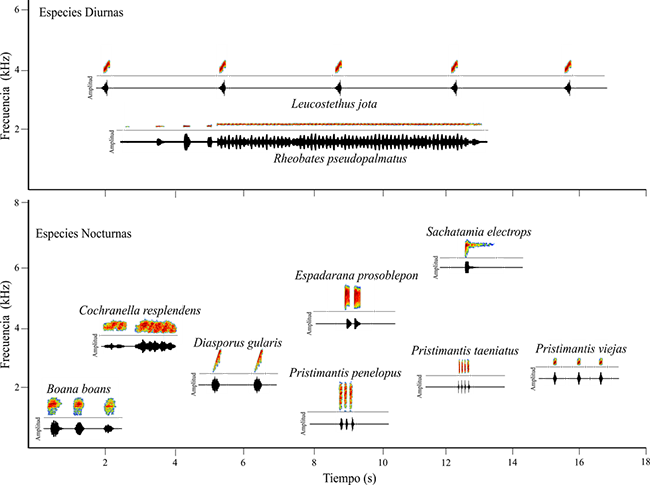
En el área de estudio se han registrado 35 especies de anuros de nueve familias (Restrepo et al., 2017a). De este conjunto de especies seleccionamos diez especies a las que se les reconoce su llamado de anuncio, Boana boans, Cochranella resplendens, Diasporus gularis, Espadarana prosoblepon, Leucostethus jota, Pristimantis penelopus, Pristimantis taeniatus, Pristimantis viejas, Rheobates pseudopalmatus y Sachatamia electrops.
La detección de estas especies se realizó usando los archivos obtenidos del monitoreo acústico pasivo y a través de sus llamados de anuncio. La identificación de los llamados fue realizada mediante la inspección visual en espectrogramas obtenidos con el programa Raven Pro1.5 (Cornell Lab of Ornithology, Ithaca, NY), incluyendo como parámetros de configuración: ventana de muestreo Hann, FFT de 516 puntos, tasa de muestreo de 24 kHz, 16 bit de precisión y un 50 % de superposición.
Ocupación del espectro acústico.
La ocupación del espectro acústico (OE) se define como el porcentaje del espectro acústico disponible que está siendo utilizado por fuentes sonoras (Xue et al., 2013). Dicha ocupación se determina calculando la relación entre la suma de los rangos de frecuencia utilizados por las fuentes sonoras del sitio y el espectro acústico total muestreado en el monitoreo pasivo. Dicha relación está dada por:
donde es el espectro acústico muestreado (i. e., 12 kHz), es el rango de cada banda de frecuencias que está siendo utilizada, es el número de bandas de frecuencia, e i=1,…,n es el índice del rango correspondiente a cada banda de frecuencia. OE toma valores entre 0-100 %, donde 100 significa que todo el espectro acústico disponible está siendo utilizado y valores cercanos a cero indican sitios con baja ocupación del espectro.
Para determinar las bandas de frecuencias usadas en cada sitio, usamos la estimación de densidad de kernel (KDE) sobre la densidad espectral de potencia. Esta técnica estima la función de densidad de probabilidad de las bandas de frecuencia que están siendo ocupadas en el paisaje acústico y determina automáticamente los extremos de dichas bandas. El método consiste en hallar los picos de las bandas de frecuencias más prominentes (i.e., sobre el ruido de fondo), para luego generar distribuciones de probabilidad que estimen la forma de la distribución espectral de potencia de los sonidos en dichas bandas. Esto permite encontrar automáticamente los límites espectrales de las bandas de frecuencia que están siendo utilizadas en el paisaje acústico, e incluso estimar las bandas de frecuencia para fuentes sonoras que se solapan. Las distribuciones fueron generadas utilizando un kernel gaussiano y se usó la anchura a media altura (FWHM) como criterio para hallar automáticamente el rango de cada banda (Anexo 1). El método fue programado en Matlab ver. R2017a (MathWorks, 2017).
Caracterización del hábitat.
En el área de estudio las condiciones de temperatura y humedad no presentaron heterogeneidad; por lo tanto, para la caracterización del hábitat tuvimos en cuenta variables asociadas al paisaje y, a partir de un análisis preliminar de correlación entre variables, seleccionamos aquellas no correlacionadas y que podían estar asociadas con aspectos biológicos de los Anuros. Seleccionamos dos variables relacionadas con la cobertura vegetal: el porcentaje de cobertura de bosque (CB) y el índice de fragmentación (FRAG). Adicionalmente, también se seleccionaron dos variables asociadas con la topografía: la pendiente (PEND) y la rugosidad (RUG), debido a que los puntos de muestreo están asociados a microcuencas y ambas variables se relacionan con características de estas. La pendiente se relaciona positivamente con la hostilidad de hábitats y con la escorrentía presente en microcuencas, y la rugosidad tiene una relación positiva con la presencia de microcuencas (Binay & Uday, 2011).
Las variables se estimaron en ArcGIS 10.1 (ESRI 2012), para áreas delimitadas por un radio de 100 m desde el punto de instalación de las grabadoras SM4; seleccionamos este radio debido a que se ha demostrado que la presencia de anuros es afectada por variables del paisaje medidas a esta o mayores escalas (Ribeiro et al., 2018). La variable CB se calculó como la proporción de cobertura de bosque dentro del área. FRAG se estimó mediante el índice de entropía en la plataforma GUIDOS toolbox (Vogt & Riitters, 2017). La estimación se basó en una capa ráster binaria de coberturas terrestres reclasificada (resolución de 30 x 30 m), usando en primer plano la cobertura de bosque y como fondo las demás coberturas (coberturas no boscosas). La entropía proporciona una medida de fragmentación normalizada a partir de las diferencias espaciales entre planos (cobertura de bosque y demás coberturas), con los valores mínimos asociados a coberturas de bosque conectadas y compactas, mientras que los valores máximos se asocian con coberturas dispersas y diseminadas (Vogt, 2015). Las variables topográficas PEND y RUG se estimaron a partir de un modelo de elevación digital (DEM) de resolución 12.5 x 12.5 m obtenido de PRISM (Panchromatic Remote-Sensing Instrument for Stereo Mapping). La pendiente se expresó en porcentaje y la rugosidad del terreno se midió a través del vector de rugosidad VRM (Vector Ruggedness Measure; Sappington et al., 2007).
Modelos de ocupación
Estimamos la ocupación para cada especie a través de matrices de presencia-ausencia construidas para los 30 sitios de muestreo, y la implementación de modelos de ocupación de temporada única (MacKenzie et al., 2006). Las matrices de detección incluyeron cinco eventos de detección constituidos por doce horas de grabación (06:00 a 18:00 horas en especies diurnas y 18:00 a 06:00 horas en especies nocturnas). A partir de los modelos de ocupación estimamos los parámetros de probabilidad de detección (p) y probabilidad de ocupación (ѱ), mediante el método de máxima verosimilitud con el paquete “unmarked” de R (Fiske & Chandler, 2011). Para la estimación de ѱ, se utilizaron las variables del hábitat (CB, FRAG, PEND y RUG) y la ocupación del espectro acústico (OE) como covariables de sitio. Para evitar sesgos en las estimaciones de ѱ decidimos mantener constante el parámetro p, debido a que las variables medidas en este estudio no presentan heterogeneidad entre eventos de detección (MacKenzie et al., 2006). Antes de incorporar las variables a los modelos de ocupación y con el fin de tener la misma dimensionalidad entre estas, realizamos una estandarización por valores medios de cada una, y realizamos pruebas de correlación para determinar que las variables no estén correlacionadas; ambos procesos se realizaron con el paquete “base” de R (Core Team 2019).
Realizamos los modelos de ocupación para las diez especies de anuros en dos pasos. Primero generamos modelos únicamente con las variables de hábitat, siguiendo la metodología de reemplazo secuencial (Smith, 2018). Este método inicia con un modelo que no incluye variables explicativas, consecutivamente se van agregando las variables más contribuyentes, y al final se eliminan aquellas variables que no mejoran el ajuste del modelo. Como segundo paso, a los modelos seleccionados previamente se les adicionó la variable OE, siguiendo la misma metodología anterior. Comparamos los modelos según el Criterio de Información de Akaike (Akaike, 1974) (AIC), y seleccionamos el modelo con menor AIC como el más adecuado para la estimación de ѱ (Burnham & Anderson, 2002). Ajustamos los modelos en dos pasos debido a que los anuros presentan requerimientos ecológicos específicos para su reproducción y desarrollo, asociados con diferentes variables ambientales, por lo cual consideramos que los modelos aditivos entre variables del hábitat y del espacio acústico tienen mayor sentido biológico que los modelos que solo incluyen la ocupación del espectro acústico.
Determinamos la significancia de las variables en la estimación de ѱ mediante los intervalos de confianza de los coeficientes de regresión asociados a cada una de ellas. Debido a que el tamaño de muestra es pequeño, consideramos un intervalo con una confianza del 90%, ya que este posee un mayor poder para detectar efectos de variables en muestras pequeñas (Kéry & Royle, 2015). Por último, evaluamos la bondad de ajuste del modelo seleccionado para cada especie mediante las pruebas de Chi-cuadrado, Freeman-Tukey y la suma de cuadrados residuales, las cuales se desarrollaron utilizando Bootstrap paramétricos con 1000 réplicas en el paquete “unmarked” (Fiske et al., 2011).
Resultados
Monitoreo acústico pasivo y detección de especies.
Obtuvimos un total de 17 660 archivos de sonido con duración de un minuto (587 a 589 archivos por sitio). Encontramos que el ensamble de anuros evaluado usa conjuntamente un espacio acústico entre los 0.74 a 6.9 kHz;las especies diurnas utilizan el espectro entre los 1.7 a 5.0 kHz, y las nocturnas entre los 0.74 a 6.9 kHz (Anexo 1). La especie con un mayor número de detecciones fue Espadarana prosoblepon, con 76 detecciones en 19 sitios, seguida por las especies Diasporus gularis, Leucostethus jota y Sachatamia electrops con 67, 58 y 38 detecciones en 14, 14 y 12 sitios respectivamente. La especie con menor número de detecciones fue, Pristimantis penelopus con 18 detecciones en ocho sitios, seguida de las especies Boana boans, Pristimantis viejas, Pristimantis taeniatus y Rheobates pseudopalmatus con 19, 23, 22 y 25 detecciones en 7, 8, 11 y 11 sitios, respectivamente.
Modelos de ocupación.
Encontramos que la ocupación de cada especie estuvo asociada con al menos una de las variables descriptoras del hábitat y todos los modelos de ocupación seleccionados fueron adecuados según las pruebas de bondad de ajuste (Tabla 1). Las especies con mayor probabilidad de detección fueron Diasporus gularis y Leucostethus jota, con probabilidades de 96 y 83 %, mientras que las de más baja detección fueron Pristimantis penelopus y Pristimantis viejas, con probabilidades de 43 y 35 %, respectivamente (Tabla 1). En cuanto a la probabilidad de ocupación, Espadarana prosoblepon presentó una probabilidad estimada del 66 %, mientras que Boana boans tuvo menor ocupación, con el 12 % (Tabla 1).
Tabla 1: Modelos de ocupación para diez especies de anuros en la vertiente oriental del norte de la Cordillera Central en Antioquia, Colombia, a partir de detecciones de sus llamados de anuncio
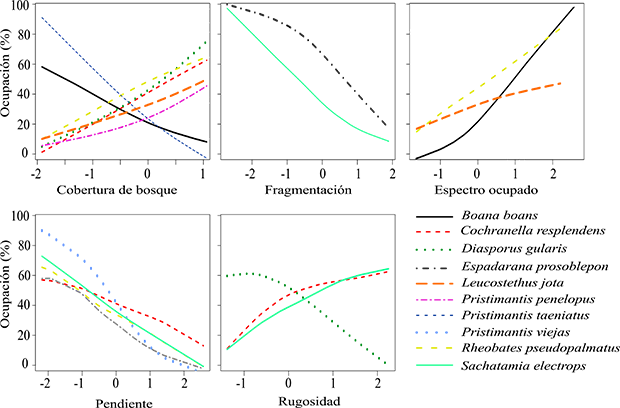
Las variables asociadas con la ocupación de la mayoría de las especies fueron CB y PEND, con siete y cinco especies, respectivamente, en comparación con las variables FRAG y RUG, asociadas con la ocupación de solo dos especies (Figura 2).
Figura 2: Relaciones significativas entre la probabilidad de ocupación y las variables descriptoras del hábitat y el uso del espectro acústico para diez especies de anuros en la vertiente oriental del norte de la Cordillera Central en Antioquia, Colombia.
Encontramos patrones contrastantes en la probabilidad ocupación asociados con la variable CB, con cinco especies Cochranella resplendens, Diasporus gularis, Leucostethus jota, Pristimantis penelopus y Rheobates pseudopalmatus que presentaron un aumento en la probabilidad de ocupación en sitios con una mayor cobertura de bosque, mientras que la probabilidad de ocupación de Boana boans y Pristimantis taeniatus disminuyó con el aumento de esta variable.
Encontramos que los patrones de ocupación asociados con las variables FRAG y PEND fueron negativos, indicando que la probabilidad de ocupación de Espadarana prosoblepon y Sachatamia electrops disminuye con el aumento de la fragmentación de paisaje. Adiconalmente, la ocupación de Cochranella resplendens, Pristimantis penelopus, Pristimantis viejas, Rheobates pseudopalmatus y Sachatamia electrops fue mayor en áreas con pendientes poco pronunciadas. En cuanto a la variable RUG, los resultados muestran una asociación positiva con la ocupación de C. resplendens y S. electrops. En el caso de Diasporus gularis la probabilidad de ocupación fue menor en sitios con una alta rugosidad.
Al incluir la variable OE en los modelos con variables del hábitat, se mejoraron cuatro de estos, correspondientes a las especies Boana boans, Espadarana prosoblepon, Leucostethus jota y Rheobates pseudopalmatus. La variable OE también fue significativa en tres modelos, debido a que los intervalos de confianza asociados a ella no incluyen el cero (Anexo 2). Para la especie E. prosoblepon, la variable OE no fue significativa, dado que el intervalo de confianza contiene el cero, por lo que seleccionamos el modelo con únicamente la variable FRAG como el más adecuado en la estimación de su ocupación. Los patrones de ocupación asociados con OE fueron positivos para B. boans, Leucostethus jota y R. pseudopalmatus, indicando una mayor probabilidad de ocupación de estas especies en sitios con una alta ocupación del espectro acústico.
Discusión
Las probabilidades de ocupación de las especies seleccionadas se asociaron con al menos una de las variables ambientales evaluadas, y se observó que los patrones de ocupación resultantes de estas asociaciones fueron heterogéneos entre especies, lo cual indica que tienen requerimientos ecológicos específicos que se reflejan en sus ocupaciones, tal y como se ha encontrado en otras especies de anuros (Ribeiro et al., 2018; Rivera & Folt, 2018). Para Boana boans, Leucostethus jota y Rheobates pseudopalmatus el uso del espectro acústico fue significativo en su ocupación. El análisis de las variables ambientales en conjunto permitió establecer diferencias entre los hábitats ocupados por estas especies, puesto que ocupan sitios con un alto uso del espacio acústico, pero con porcentajes de cobertura de bosque contrastantes. En consecuencia, la sinergia entre las variables del hábitat y del espectro acústico permiten tener una mejor comprensión de cómo las variables ambientales se asocian y afectan la ocupación de estas tres especies. Por esta razón, variables de hábitat, de ocupación espectral y quizás otras variables asociadas con el paisaje acústico deben ser incluidas explícitamente en estudios que buscan identificar los factores ambientales que determinan atributos poblacionales en anuros.
Evidenciamos un proceso de selección del hábitat acústico de las especies Boana boans, Leucostethus jota y Rheobates pseudopalmatus(Mullet et al., 2017), resultando en una adaptación acústica a hábitats con alto uso del espectro acústico. Los llamados de anuncio de estas tres especies hacen parte de la composición acústica de sus hábitats, y presumiblemente las bandas de frecuencia ocupadas por esos llamados no están en conflicto con sonidos procedentes de otras fuentes, es decir que el espacio acústico está particionado, como se ha encontrado en otras comunidades de anuros (Sinsch et al., 2012). La ocupación del espectro acústico está relacionada con la riqueza de especies de un sitio, y se espera que a mayor número de especies mayor número de frecuencias ocupadas (i.e., mayor OE), pero no es posible identificar cuáles son las bandas de frecuencia ocupadas, lo cual no permite inferir qué procesos biológicos generan los patrones de ocupación espectral. Esto abre la posibilidad de realizar estudios futuros con medidas de la heterogeneidad no recuperada por la ocupación espectral, y determinar si las bandas de frecuencia usadas por las especies de interés son ocupadas por otros sonidos. Esto posibilitará la evaluación de hipótesis tan controversiales como competencia acústica, adaptación acústica y nicho acústico (Ey & Fischer, 2009; Goutte et al., 2018; Wilson et al., 2020).
El uso del espectro acústico no fue determinante en la ocupación de siete especies. Esto posiblemente se debe a que las variables del hábitat son más importantes para su presencia que el uso del espacio acústico. Encontramos que la cobertura de bosque fue la variable con mayor relevancia en la ocupación de las especies, presentando patrones de ocupación diferentes entre estas, inclusive en aquellas relacionadas evolutivamente y con historias de vida similares (e.g., Pristimantis penelopus y Pristimantis taeniatus). La mayor relevancia de la cobertura de bosque se debe a que esta variable condiciona características microclimáticas de los hábitats, como la temperatura, la humedad y la disponibilidad de fuentes de agua, que afectan la ocupación de anuros (Zellweger et al., 2018; Valenzuela-Sánchez et al., 2019). Por consiguiente, es coherente que siete de las diez especies de anuros presenten modelos de ocupación afectados por la cobertura de bosque, como se ha evidenciado en otros estudios (Groff et al., 2017; Ribeiro et al., 2018; Westgate et al., 2018). Por otro lado, las diferencias encontradas en los patrones de ocupación se deben a las adaptaciones ecológicas de las especies, ya que P. penelopus es una especie que se encuentra en bosques secundarios (Restrepo et al., 2017b), mientras que P. taeniatus es típica de zonas abiertas y perturbadas (Duarte-Marín et al., 2018).
Los resultados referentes a la cobertura de bosque se convierten en una herramienta potencial para monitorear procesos de sucesión ecológica a escalas locales, dado que la cobertura de bosque es una variable que está relacionada con este proceso (Murphy et al., 2010). De acuerdo con lo propuesto por Mackenzie et al. (2011) hay una dinámica simultánea entre el hábitat y el estado de ocupación de las especies, la cual puede ser modelada para entender cambios transicionales entre el hábitat y su influencia en la ocupación de especies. Recíprocamente, un análisis de la dinámica ocupacional de un grupo de especies focales puede ser usado para predecir cambios en las coberturas vegetales, cambios que pueden ser derivados de procesos como la restauración ecológica (Silvano et al., 2017) y la perturbación (Mestre et al., 2020). Nuestro estudio mostró patrones de ocupación contrastantes asociados con la cobertura de bosque, los cuales indican relaciones con niveles avanzados, (p. ej., C. resplendens y D. gularis), y niveles bajos (p. ej., B. boans y P. taeniatus) de sucesión ecológica. Por eso es de esperar que, a una escala temporal amplia, el monitoreo de estos patrones de ocupación permita evidenciar procesos de sucesión ecológica, convirtiendo estas especies en focos para monitoreos a escalas locales del paisaje.
Por otro lado, las especies Espadarana prosoblepon y Sachatamia electrops, presentaron mayor probabilidad de ocupación en sitios con baja fragmentación. Ambas especies habitan en sitios con corrientes de agua permanentes, donde realizan sus posturas, depositando sus huevos en la superficie de hojas de vegetación aledañas a quebradas (Angeli et al., 2015; Rada et al., 2017). Por consiguiente, sus bajas probabilidades de ocupación en sitios con alta fragmentación posiblemente se debe a que esta variable afecta la disponibilidad de sitios adecuados para su reproducción y desarrollo, considerando que la fragmentación a escalas locales tiene efectos negativos en la vegetación ribereña (Ficetola & De Bernardi, 2004), y a escalas mayores, en la disponibilidad de agua en quebradas (Fuller et al., 2015).
También encontramos que las variables topográficas presentaron una alta relevancia en la ocupación de anuros. Por un lado, mostramos que cinco especies presentaron menor probabilidad de ocupar sitios con pendientes muy pronunciadas. Nosotros asociamos la pendiente con la hostilidad del hábitat (Goutte et al., 2013), ya que consideramos que sitios con pendientes muy pronunciadas requieren mayor esfuerzo para el desplazamiento de individuos (Ribeiro et al., 2018), y atributos morfológicos específicos para permanecer en zonas con dichas características (Strauß et al., 2012). Además, las especies Cochranella resplendens, Sachatamia electrops y Rheobates pseudopalmatus han sido registradas en corrientes bajas (Molina-Zuluaga et al., 2017; Rada et al., 2017); por consiguiente, corrientes muy altas pueden afectar sus posturas o el establecimiento de renacuajos (Rivera & Folt, 2018). Dado el conocimiento previo sobre las preferencias de hábitat en estas tres especies, es coherente encontrar que la pendiente afecte negativamente su probabilidad de ocupación. En cuanto a los patrones encontrados para las especies dePristimantis analizadas, las cuales no se asocian a corrientes de agua, posiblemente se deben a que los individuos requieran una inversión alta de energía para desplazarse en zonas con pendientes muy pronunciadas (Ribeiro et al., 2018).
La otra variable topográfica (rugosidad del terreno), estuvo asociada positivamente con la ocupación de Cocranella resplendens y Sachatamia electrops. Esta variable la relacionamos con la presencia de microcuencas: a mayor rugosidad del paisaje mayor es la presencia de microcuencas (Binay & Uday, 2011). A pesar de la poca información ecológica documentada para estas dos especies (Molina-Zuluaga et al., 2017; Rada et al., 2017), ambas han sido registradas en quebradas, por lo que hay mayores probabilidades de ocupación en sitios con una alta disposición de corrientes de agua.
En conclusión, evidenciamos la importancia de la estructura del paisaje, incluyendo el paisaje acústico, en la presencia de organismos con comunicación acústica, como los anuros. Al igual que las coberturas vegetales y la topografía, concluimos que la ocupación espectral de un hábitat también se asocia con la ocupación de anuros, y debe ser considerada como una variable ambiental que puede determinar la presencia de especies con comunicación acústica. Finalmente, este estudio expone el potencial de la sinergia entre el monitoreo acústico pasivo y la caracterización del paisaje con sensores remotos, para predecir patrones a niveles de población, comunidad y paisaje.





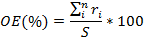
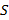 es el espectro acústico muestreado (i. e., 12 kHz), r
es el espectro acústico muestreado (i. e., 12 kHz), r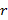 es el rango de cada banda de frecuencias que está siendo utilizada, n
es el rango de cada banda de frecuencias que está siendo utilizada, n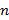 es el número de bandas de frecuencia, e i=1,…,n
es el número de bandas de frecuencia, e i=1,…,n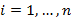 es el índice del rango correspondiente a cada banda de frecuencia. OE toma valores entre 0-100 %, donde 100 significa que todo el espectro acústico disponible está siendo utilizado y valores cercanos a cero indican sitios con baja ocupación del espectro.
es el índice del rango correspondiente a cada banda de frecuencia. OE toma valores entre 0-100 %, donde 100 significa que todo el espectro acústico disponible está siendo utilizado y valores cercanos a cero indican sitios con baja ocupación del espectro.