Resumen (es):
Se evaluó la variación morfológica de Heterophrynus boterorum con relación a su distribución geográfica, comparando poblaciones de la vertiente oriental y occidental de la cordillera Central y una población de la cordillera Oriental de los Andes, en los departamentos de Tolima y Quindío, Colombia. Mediante técnicas de estadística univariada y multivariada, (ACP, ANOVA y Kruskal-Wallis), se compararon poblaciones presentes en municipios de ambas vertientes y cordilleras. Se encontró variación entre poblaciones en 15 de 33 caracteres morfológicos examinados. La mayor variación se encontró en el tamaño de palpos, número de espinas y tubérculos. La población del municipio de Lérida se diferenció notablemente de las demás poblaciones del análisis. El resto de poblaciones formaron un grupo morfológico con amplia variabilidad, principalmente en tamaño. Heterophrynus boterorum podría considerarse como modelo de estudio para el efecto del gradiente ambiental y altitudinal de los Andes en la diversificación morfológica de los Amblypygi.
Resumen (en):
We assessed the morphological variation of Heterophrynus boterorum in relation to its distribution, by comparing populations of the eastern and western slopes of the Central mountain range and a population of the Eastern Andes, in the departments of Tolima and Quindío, Colombia. Populations located in both slopes and mountain range were compared using univariate and multivariate statistical techniques (ACP, ANOVA, Kruskal-Wallis). Variation among populations was found in 15 out of 33 morphological characters examined. The greatest variation was in the size of palps, number of spines and tubers. The population of the municipality of Lérida differed notably from those of other populations in the analysis. The rest of the populations formed a morphological group with wide variability, particularly in size. Heterophrynus boterorum could be considered as a model species for studying the effect of the environmental and altitudinal gradient of the Andes in the morphological diversification of Amblypygi.
Palabras clave:
Morphological characters, Population, Environmental variability, Phenotypic variation, Population variation (en)
https://doi.org/10.21068/c2019.v20n02a03
Variación morfológica en Heterophrynus boterorum (Arachnida: Amblypygi: Phrynidae)
Morphological variation in Heterophrynus boterorum (Arachnida: Amblypygi: Phrynidae)
Sebastián Vásquez Palacios
Universidad del Quindío
Armenia, Colombia
Daniel Andrés Chiriví Joya
Universidad de Sao Paulo
Sao Paulo, Brasil
Andrea Lorena García Hernández
Universidad del Quindío
Armenia, Colombia
Hugo Mantilla-Meluk
Universidad del Quindío
Armenia, Colombia
Jhon Deiber Torres Carrera
Universidad del Quindío
Armenia, Colombia
Recibido: 29 de mayo de 2018
Aceptado: 15 de agosto de 2019
Resumen
Se evaluó la variación morfológica de Heterophrynus boterorum con relación a su distribución geográfica, comparando poblaciones de la vertiente oriental y occidental de la cordillera Central y una población de la cordillera Oriental de los Andes, en los departamentos de Tolima y Quindío, Colombia. Mediante técnicas de estadística univariada y multivariada, (ACP, ANOVA y Kruskal-Wallis), se compararon poblaciones presentes en municipios de ambas vertientes y cordilleras. Se encontró variación entre poblaciones en 15 de 33 caracteres morfológicos examinados. La mayor variación se encontró en el tamaño de palpos, número de espinas y tubérculos. La población del municipio de Lérida se diferenció notablemente de las demás poblaciones del análisis. El resto de poblaciones formaron un grupo morfológico con amplia variabilidad, principalmente en tamaño. Heterophrynus boterorum podría considerarse como modelo de estudio para el efecto del gradiente ambiental y altitudinal de los Andes en la diversificación morfológica de los Amblypygi.
Palabras clave. Caracteres morfológicos. Poblaciones. Variabilidad ambiental. Variación fenotípica. Variación poblacional.
Abstract
We assessed the morphological variation of Heterophrynus boterorum in relation to its distribution, by comparing populations of the eastern and western slopes of the Central mountain range and a population of the Eastern Andes, in the departments of Tolima and Quindío, Colombia. Populations located in both slopes and mountain range were compared using univariate and multivariate statistical techniques (ACP, ANOVA, Kruskal-Wallis). Variation among populations was found in 15 out of 33 morphological characters examined. The greatest variation was in the size of palps, number of spines and tubers. The population of the municipality of Lérida differed notably from those of other populations in the analysis. The rest of the populations formed a morphological group with wide variability, particularly in size. Heterophrynus boterorum could be considered as a model species for studying the effect of the environmental and altitudinal gradient of the Andes in the morphological diversification of Amblypygi.
Keywords. Environmental variability. Morphological characters. Phenotypic variation. Population. Population variation.
Introducción
Los Amblypygi son un orden de Arachnida que se distribuye principalmente en la región tropical. Se caracterizan por presentar un cuerpo dorso-ventralmente aplanado, pedipalpos ornamentados con espinas y un primer par de patas largas y delgadas (Weygoldt, 2000).
En Colombia se han registrado las familias Charinidae (género Charinus) y Phrynidae (géneros Heterophrynus, Phrynus y Paraphrynus) (Armas et al., 2012; Chiriví & Armas, 2012). La familia Phrynidae se distribuye ampliamente en Colombia, encontrando especies desde zonas secas hasta bosques húmedos montanos. Sin embargo, pocas especies son simpátricas (Giupponi & Kury, 2013; Víquez et al., 2014; Álvarez-García et al., 2015; Armas et al., 2015). El género Heterophrynus está representado en Colombia por siete especies: H. armiger (Isla Gorgona), H. batesii (Amazonas y Meta), H. caribensis (Sucre), H. cervinus (Putumayo), H. silviae (Valle del Cauca), H. yarigui (Santander), y H. boterorum. Heterophrynus boterorum se distribuye en los Andes de Colombia, entre los departamentos del Quindío y Tolima, entre los 900 y 1973 m s.n.m. (Armas et al., 2013; Giupponi & Kury, 2013).
El sistema montañoso de los Andes se originó aproximadamente hace 10 millones de años. Por su altura y extensión, ha dado origen a una gran cantidad de hábitats con condiciones ambientales únicas, favoreciendo procesos de aislamiento y diversificación entre las especies (De-Silva et al., 2017; Díaz et al., 2014; Salgado-Roa et al., 2018). Actualmente, no se tiene certeza sobre el efecto de la cordillera de los Andes en las poblaciones de H. boterorum; sin embargo, podría estar actuando como barrera para el flujo genético (Miller et al., 2008). Se han documentado procesos de aislamiento que dan origen a la diversificación de otros géneros de amblipígidos en sistemas de arenas en el desierto del Kalahari (Damon), y en sistemas de islas y cavernas del Caribe (Phrynus) (Esposito et al., 2015; Futuyma, 1998; Prendini et al., 2005; Punzo & Reeves, 2001; Quintero, 1981; Suzuki, 1974; Torres et al., 2018). Los procesos de aislamiento genético también suelen estar acompañados de procesos de diferenciación morfológica (Hedin & Thomas, 2010). Bajo esta premisa, en este estudio se caracterizó la variación morfológica presente en poblaciones de H. boterorum en diferentes localidades de los Andes de Colombia, utilizando la morfología como indicador de procesos de divergencia interespecífica.
Materiales y métodos
Análisis morfológico:
Zona de estudio. Los especímenes fueron categorizados, según su distribución, en regiones correspondientes a la cordillera Central y Oriental de los Andes de Colombia en la región del Tolima (vertiente oriental Andes Centrales y vertiente occidental Andes Orientales) y la región del Quindío (vertiente occidental Andes Centrales). Las regiones presentan condiciones ambientales contrastantes en temperatura, precipitación y humedad (Gentry, 1982; van der Hammen, 1995; Lobo-Guerrero, 1999; Gómez-Cuervo et al., 2015; Holdridge, 1947,1967; Duran, 1956), ya que la región del Tolima tiene una mayor temperatura y ambientes más secos, mientras que la región del Quindío presenta mayor precipitación y humedad relativa (IDEAM, 2018; http://www.ideam.gov.co/web/tiempo-y-clima/clima).
Material analizado. Se revisó material museológico, y se realizaron algunas recolecciones en campo, de individuos machos y hembras, entre octubre del 2010 a junio del 2015. De la vertiente oriental cordillera central y cordillera Oriental (Tolima) se obtuvieron 17 individuos, entre los 591 y 1247 m s.n.m., distribuidos en las localidades de Chaparral [n= 7], Cunday [n= 3], Ibagué [n= 2] y Lérida [n= 5]; y de la vertiente occidental cordillera Central (Quindío) se encontraron 23 individuos entre los 1457 y1935 m s.n.m. en las localidades de Armenia [n= 5], Calarcá [n=4], Circasia [n=2], Córdoba [n= 5], Filandia [n= 2] y Salento [n= 5](Figura 1).
El material fue preservado en etanol al 70 %. Los ejemplares se encuentran depositados en la Colección de Insectos de la Universidad del Quindío (CIUQ), Colección de Ictiología Universidad del Quindío (IUQ) y en el Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN), Colección Aracnológica (Anexo 1).
Se incluyeron en el análisis ejemplares machos y hembras, aunque no existen diferencias determinadas por el sexo en las variables morfológicas analizadas. Se compararon machos y hembras en cada característica evaluada utilizando pruebas T de Student, y Chi cuadrado (p>0.05), dependiendo de si los datos presentaban o no variancias homogéneas; la homogeneidad de varianzas se evaluó utilizando el test de Levene.
La terminología de pedipalpos y patas usada en este trabajo sigue a Quintero (1981), con los cambios correspondientes a la nomenclatura de cada segmento según Shultz (1999). No se sigue la terminología propuesta por Weygoldt (2000), ya que no se presentan todos los segmentos de los pedipalpos. Además, se sigue la numeración de espinas para algunos segmentos propuesta por Weygoldt (2000). Se examinaron solo ejemplares adultos, determinados como tal según el desarrollo gonadal.
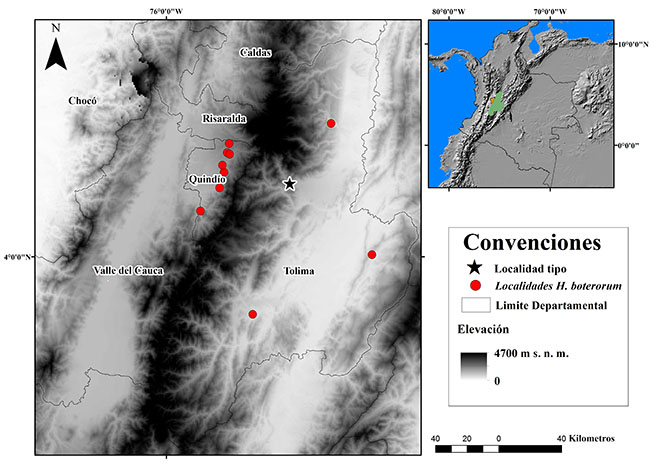
Figura 1. Área geográfica de registros poblacionales de Heterophrynus boterorum en Colombia.
Caracteres morfológicos. Se incluyeron medidas corporales reportadas en Weygoldt (1974) y en Giupponi & Kury (2013) como: longitud trocánter derecho e izquierdo (L_tr_de, L_tr_iz), longitud tibia derecha e izquierda (L_Tb_de, L_Tb_iz), ancho y largo del prosoma y opistosoma (A_pro, L_pro, A_op, L_op), longitud borde frontal del prosoma (B_fr),distancia entre el punto medio entre los dos grupos de ojos laterales y el margen frontal (DOL), longitud ocular a la línea media (DOM), longitud línea ocular (Lin_O), longitud total del cuerpo (L_to_cu) y longitud del opérculo genital (L_op_ge) (Figura 2). Para todas las mediciones se utilizó un calibrador digital Stanley y la unidad de medida fue el milímetro (mm) (Electronic Digital Calliper, error ± 0.02mm).
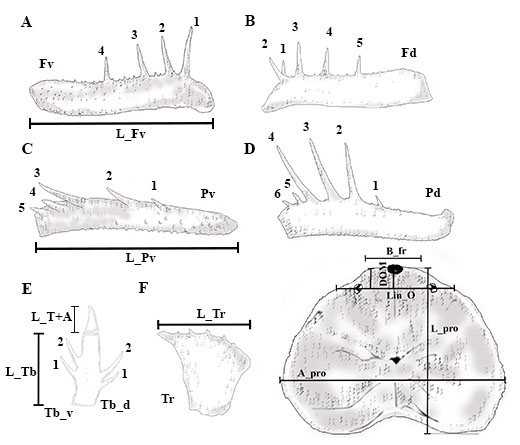
Figura 2. Mediciones realizadas sobre los ejemplares de Heterophrynus boterorum: A. Longitud del fémur vista ventral. B. Fémur vista dorsal. C. Longitud de la patela vista ventral. D. Patela vista dorsal. E. Longitud tibia vista ventral, longitud tarsos más apórtele. F. Longitud trocánter vista ventral. G. Dimensiones del prosoma: ancho, largo, longitud línea ocular, longitud borde frontal del prosoma, longitud ocular a la línea media. Se sigue la numeración en espinas de basal a distal, puesto que en otros géneros de Phrynidae se cuenta de esta manera.
Igualmente, se incluyeron caracteres discretos del tipo conteos como: número de tubérculos ventrales y dorsales en el trocánter derecho e izquierdo (Tr_vde, Tr_viz, Tr_dde, Tr_diz), número de espinas ventrales y dorsales en fémur derecho e izquierdo (Fd_de, Fd_iz, Fv_de, Fv_iz), número de espinas ventrales y dorsales en patela derecha e izquierda (Pd_de, Pd_iz, Pv_de, Pv_iz), número de dentículos en el quelícero móvil (Den_CheMov). Estos caracteres son frecuentemente usados en descripciones de especies, y suelen presentar variación (Quintero, 1981; Weygoldt, 2000; Vasconcelos et al., 2013) (Figura 2 y Anexo 2). Todos los caracteres morfológicos se observaron bajo un estereoscopio Zeiss modelo STEMI DV4 32Z de 4X a 40X.
Análisis de datos
Variabilidad morfológica.
Con la finalidad de explorar la variación en caracteres morfológicos e identificar potenciales patrones fenotípicos por localidad, se realizó un Análisis de Componentes Principales (ACP), evaluando la variación morfológica entre municipios de muestreo (Williams, 2011; Fox, 2016), a partir de este, se tomaron las variables morfológicas que presentaron mayor variación, aplicando análisis de varianza y comparación de medias (ANOVA, t-test) en caso de distribuciones normales y Kruskal-Wallis(Wilcoxon) en casos contrarios (Hollander & Wolfe, 1973; Fox & Weisberg, 2011), para así detectar variaciones morfológicas entre poblaciones (α = 0.05). Todos los datos se analizaron con ayuda del software R utilizando las paquetes “Rcmdr”, “Vegan” y “ggplot2” (Fox, 2016; Oksanen, 2013; Wickham, 2016) (R Development Core Team, 2015). Para el análisis morfológico no se incluyeron el número de segmentos en el primer par de patas y cerdas en el sternum, ya que es normal que se produzca aumento o disminución considerable cuando se rompe y posteriormente se regenera el exoesqueleto (Igelmund, 1987).
Resultados
En el morfo espacio del ACP, se encontró que entre el primer y segundo componente se acumula el 68.9% de la varianza en los datos morfológicos. En general, se encontraron altas correlaciones entre las variables morfológicas como longitudes corporales, pero baja correlación de estas con variables discretas como el número de espinas y tubérculos. Por otra parte, los ejemplares de Lérida se agruparon en relación a variables del tipo conteos (caracteres discretos).
Las variables morfológicas que tuvieron mayor variación en el CP1y CP2 para H. boterorum fueron: número de tubérculos ventrales y dorsales en el trocánter derecho e izquierdo, longitud fémur derecho e izquierdo, longitud patela derecha e izquierda, largo del opistosoma, ancho del prosoma y longitud total del cuerpo (Tabla 1). Estos caracteres morfológicos fueron importantes en la diferenciación de H. boterorum en Lérida.
Tabla 1.Vectores principales en el ACP que presentaron valores altos para las variables morfológicas en Heterophrynus boterorum en los Andes de Colombia.
En el análisis de varianza o Kruskal-Wallis, se encontraron diferencias significativas (p<0.05) en 15 caracteres morfológicos relacionados con conteos (11caracteres discretos) y mediciones corporales (cuatro caracteres continuos), al comparar las poblaciones de cada localidad (Tabla 2). Se observó que en el número de espinas en el fémur y patela, la población de Lérida se diferencia del resto, presentando siempre una espina más en estos segmentos en vista dorsal y ventral (Tabla 2). En el caso del número de dentículos en el segmento móvil queliceral, las poblaciones de Cunday, Lérida e Ibagué presentan un dentículo más que la mayoría de los especímenes, diferenciándose de las poblaciones de Calarcá, Circasia y Filandia, pero compartiendo esta misma condición con algunos individuos de poblaciones de Armenia, Chaparral, Córdoba y Salento. En cuanto a la longitud del trocánter, se encontró que los individuos de Cunday se diferenciaron del resto de individuos en la cordillera Central por su mayor tamaño (Tabla 2). La distancia ocular a la línea media de los individuos de las poblaciones de Armenia, Chaparral, Lérida y Salento fue mayor que la del resto de los individuos analizados. Igualmente, se observó en la distancia entre el punto medio entre los dos grupos de ojos laterales y el margen frontal, que los individuos de las poblaciones de Calarcá, Filandia, Ibagué, Lérida y Salento fueron significativamente diferentes del resto de individuos, por presentar longitudes mayores. El número de tubérculos en el trocánter dorsal derecho fue mayor en los individuos de Calarcá, Cunday, Filandia y Salento. Finalmente, el número de tubérculos en el trocánter dorsal izquierdo de los individuos de Armenia, Calarcá, Chaparral, Cunday, Ibagué y Lérida fue mayor que en el resto de poblaciones (Tabla 2).
Tabla 2. Caracteres morfológicos de Heterophrynus boterorum en los Andes de Colombia que presentaron diferencias significativas, por municipio. Arm, Armenia; Cal, Calarcá; Chap, Chaparral; Cir, Circasia; Cor, Córdoba; Cun, Cunday; Fil, Filandia; Iba, Ibagué; Ler, Lérida; Sal, Salento. Est, estadístico.
Discusión
Los análisis estadísticos mostraron variaciones morfológicas relacionadas con el número de tubérculos en el trocánter, número de espinas y longitudes en los palpos, indicando que la población de Lérida es un grupo morfológico diferente del resto de poblaciones del análisis. Esta variación está expresada en el aumento en los conteos de espinas del fémur y de la patela, lo que claramente los diferencia del resto de poblaciones. Los individuos de las demás poblaciones se comportaron como un grupo similar morfológicamente, que presenta amplia variabilidad en su tamaño, pero que se solapa morfológicamente entre ellos. En general no se encontraron diferencias entre la cordillera Centrales y Orientales de los Andes, ni entre vertientes para las variables analizadas; sin embargo sí se observan diferencias al comparar las poblaciones por municipio donde fueron recolectados.
Hasta el momento se han recolectado pocos individuos de H. boterorum en Colombia. Sin embargo, las diferencias morfológicas encontradas entre localidades son evidentes y probablemente se relacionan con el gradiente altitudinal al que están expuestas las poblaciones localmente (https://colombiasa.com/geografia/geografia.html). Las altas elevaciones en la cordillera Central y Oriental actúan como barrera para las poblaciones en algunos grupos de animales que se distribuyen en las cordilleras de los Andes (Díaz et al., 2014; Mills et al., 2007; Salgado-Roa et al., 2018), y en el caso de la población de Lérida, su diferenciación morfológica podría estar asociada a que se encuentra ubicada al norte de la vertiente oriental de los Andes Centrales, separada del resto de poblaciones por el Parque de los Nevados y los valles interandinos. Es importante resaltar que también las poblaciones de Cunday y Chaparral presentaron diferencias con el resto de poblaciones, que pueden estar relacionadas con las condiciones de aislamiento y distribución que presentan actualmente estas poblaciones al ser las que presentan mayor distanciamiento geográfico de la localidad tipo en Ibagué, Tolima.
El ACP muestra agrupaciones de variación por localidad, pese a que solo se encontraron dos patrones morfológicos claramente diferenciables. Esto permite pensar que la variación morfológica podría estar influenciada por la variabilidad de ambientes en los cuales se distribuye H. boterorum (Torres et al., 2018), tanto en términos de humedad (muy secos a muy húmedos), como de elevación (500-1900 m s.n.m.) y distanciamiento geográfico (70-100 km).
Hasta el momento no ha sido posible evaluar el aislamiento reproductivo y la estructura genética en H. boterorum, lo cual sería clave en el entendimiento de los procesos de diversificación y especiación del grupo (Futuyma, 1998). Sin embargo, este estudio muestra fuertes indicios de procesos de diferenciación morfológica, principalmente en la población de Lérida, lo cual indica que también pueden estar sufriendo procesos de diferenciación genética. Algunos estudios en Amblypygi han mostrado que los sistemas ecológicos de islas y cavernas promueven la diversificación del grupo, debido al bajo flujo génico que se da entre poblaciones del interior y el exterior de cavernas, y entre islas (Quintero, 1981; Kraus, 2000; Prendini, 2001; Esposito et al., 2015). Por otra parte, se sabe que los Andes de Colombia son fuente de variaciones fenotípicas y actúan como barrera del flujo genético entre poblaciones de algunos grupos de animales (De-Silva et al., 2017; Díaz et al., 2014; Ferretti et al., 2011; Román-Valencia et al., 2009; Ruiz-C et al., 2011; Salgado-Roa et al., 2018), por lo que los resultados encontrados en este trabajo, sugieren que los Andes también promueven procesos de diversificación en los amblipígidos de Colombia.
Agradecimientos
Los autores agradecen a las personas que brindaron apoyo logístico, humano y facilitaron la recolección de muestras en áreas de especial interés para este trabajo, a la Universidad del Quindío, al Instituto de Ciencias Naturales, Universidad Nacional de Colombia, a sus colecciones científicas (CIUQ, IUQ, ICN) y curadores por la ayuda prestada. Finalmente, a los revisores anónimos por los comentarios y sugerencias que ayudaron a mejorar el manuscrito.
Referencias
Álvarez-García, D. M., Armas, L. F. & Díaz-Pérez, J. A. (2015). Una especie nueva de Heterophrynus (Amblypygi: Phrynidae) del nordeste de Colombia. Revista Ibérica de Aracnología, 27, 45-49.
Armas, L. F., Chiriví-Joya, D., Botero-Trujillo, R., Camacho-Cortés, G. P. & García,S. (2012). Presencia en Colombia de la familia Charinidae (Arachnida: Amblypygi). Boletín de la Sociedad Entomológica Aragonesa, 50, 321-322.
Armas, L. F., Delgado-Santa, L. & García-Cárdenas, D. R. (2013). Primer registro de Heterophrynu boterorum GiupponiyKury, 2013 (Amblypygi: Phrynidae) para el departamento de Quindío, Colombia. Revista Ibérica de Aracnología, 23, 115-116.
Armas, L. F., Torres-Contreras, R. & Álvarez-García, D. M. (2015). Nueva especie de Heterophrynus (Amblypygi: Phrynidae) del Caribe Colombiano. Revista Ibérica de Aracnología, 26, 69-73.
Carrillo, P. & Ivveth, K. (2012). Variación morfológica y genética de Tamarixia radiata (Waterston) (Hymenoptera: Eulophidae) en los estados de Colima, Nuevo León, Tamaulipas y Michoacán, México. (Tesis de grado). Nuevo León, México: Universidad Autónoma de Nuevo León.
Chirivi, D. A. & Armas, L. F. (2012). La subfamilia Phryninae (Amblypygi: Phrynidae) en Colombia. Boletín de la Sociedad Entomológica Aragoneza, 50, 395-402.
De-Silva, D. L., Chazot, N., Silva, K. L., Lamas, G., Mallet, J., Willmott, K. R. & Elias, M. (2017). Origen del norte de los Andes y diversificación del género más grande de mariposa Ithomiine. Informes científicos, 7, 45966.
Díaz, S., Panzera, F., Jaramillo-O, N., Pérez, R., Fernández, R., Vallejo, G. & Gómez-Palacio, A. (2014). Genetic, cytogenetic and morphological trends in the evolution of the Rhodnius (Triatominae:Rhodniini) trans-Andean group. PLoSOne, 9(2), e87493.
https://doi.org/10.1371/journal.pone.0087493
Duran, L. G. (1956). Historia geológica de Colombia. Revista de la Academia Colombiana de Ciencias, 43, 137-191.
Esposito, L. A., Bloom, T., Caicedo-Quiroga, L., Alicea-Serrano, A. M., Sánchez-Ruíz, J. A., May-Collado, L. J., Binford, G. J. & Agnarsson, I. (2015). Islands within islands: Diversification of tailless whip spiders (Amblypygi, Phrynus) in Caribbean caves. Molecular Phylogenetics and Evolution, 93, 107-117.
https://doi.org/10.1016/j.ympev.2015.07.005
Ferretti, N., González, A. & Pérez-Miles, F. (2011). Historical biogeography of the genus Cyriocosmus (Araneae: Theraphosidae) in the Neotropics according to an event-based method and spatial analysis of vicariance. Zoological Studies, 51(4), 526-535.
Fox, J. & Weisberg, S. (2011). An R Companion to Applied Regression. Second edition. Thousand Oaks, USA: Sage publications Inc.
Fox, J. (2016). Using the R Commander: A Point-and-Click Interface for R. Ontario, Canada: Chapman and Hall/CRC Press
https://doi.org/10.1201/9781315380537
Futuyma, D. J. (1998). Evolutionary Biology. Third Edition. New York: SUNY Stony Brook.
Gentry, A. (1982). Neotropical floristic diversity: phytogeographical connections between Central and South America, pleistocene climatic fluctuation or an ancient of the Andean orogeny. Annals of the Missouri Botanical Garden, 69(3), 557-593.
https://doi.org/10.2307/2399084
Giupponi, A. L. P. & Kury, A. B. (2013).Two new species of Heterophrynus Pocock, 1894 from Colombia with distribution notes and a new synonymy (Arachnida: Amblypygi: Phrynidae). Zootaxa, 3647(2), 329-342.
https://doi.org/10.11646/zootaxa.3647.2.5
Gómez-Cuervo, A., Pérez-Consuegra, N. & Lamus-Ochoa, F. (2015). Levantamiento de la Cordillera Oriental de los Andes colombianos. Hipótesis, Apuntes Científicos Uniandinos, 19, 66-73.
Hedin, M. & Thomas, S. M. (2010). Molecular systematics of eastern North American Phalangodidae (Arachnida: Opiliones: Laniatores), demonstrating convergent morphological evolution in caves. Molecular Phylogenetics and Evolution, 54(1), 107-121.
https://doi.org/10.1016/j.ympev.2009.08.020
Heiberger, R. M., Freeny, A. E. & Chambers, J. M. (2017). Analysis of variance; designed experiments. En Chambers, J. M. & Hastie, T.J.(Eds). Statistical models in S. Pp. 145-193. Londres, Inglaterra: Routledge.
https://doi.org/10.1201/9780203738535-5
Hollander, M. & Wolfe,D. A. (1973). Non parametric Statistical Methods. Second edition. New York: John Wiley & Sons.
Holdridge, L. R. (1947). Determination of world plant formations from simple climatic data. Science, 105(2727), 367-368.
https://doi.org/10.1126/science.105.2727.367
Holdridge, L. R. (1967). Life zone ecology.San José, Costa Rica: Tropical Science Center.
Igelmund, P. (1987). Morphology, sense organs, and regeneration of the forelegs (whips) of the whip spider Heterophrynus elaphus (Arachnida, Amblypygi). Journal of Morphology, 193(1), 75-89.
https://doi.org/10.1002/jmor.1051930108
Kraus, O. (2000). Why no subspecies in spiders?. European Arachnology, 2000, 303-314.
Lobo-Guerrero, A. (1999). Infraestructura de Colombia. En MemoriasV Congreso colombiano de geotecnia y medio ambiente. Bogotá, D.C.
Miller, M. J., Bermingham, E., Klicka, J., Escalante, P., Do Amaral, F. S. R., Weir, J. T. & Winker, K. (2008). Out of Amazonia again and again: episodic crossing of the Andes promotes diversification in a lowland forest flycatcher. Proceedings of the Royal Society B: Biological Sciences, 275(1639), 1133-1142.
https://doi.org/10.1098/rspb.2008.0015
Mills, S., Lunt, D. H. & Gómez, A. (2007).Global isolation by distance despite strong regional phylogeography in a small metazoan.BMC Evolutionary Biology, 7(1), 225.
https://doi.org/10.1186/1471-2148-7-225
Oksanen, J. (2013). Vegan: ecological diversity. See hokudai. ac. jp (accessed 15 August 2014).
Prendini, L. (2001). Substratum specialization and speciation in southern African scorpions: the Effect Hypothesis revisited. Scorpions, 113-138.
Prendini, L., Weygoldt, P. & Wheelera,W. C. (2005). Systematics of the Damon variegatus group of African whip spiders (Chelicerata: Amblypygi): Evidence from behaviour, morphology and DNA. Organisms, Diversity & Evolution, 5(3), 203-236.
https://doi.org/10.1016/j.ode.2004.12.004
Punzo, F. & Reeves, C. (2001). Geographical variation in male courtship behaviour of the giant whip scorpion Mastigoproctus giganteus (Lucas) (Arachnida, Uropygi). Bulletin British Arachnological Society, 12(2), 93-96.
Quintero, D. (1981). The amblypygid genus Phrynus in the Americas (Amblypygi, Phrynidae). Journal Arachnology, 9(2), 117-166.
R Development Core Team. (2012). R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing. Internet: http://www.R-project.org.
Rix, M. G. & Harvey, M. S. (2011). Phylogeny and historical biogeography of ancient assassin spiders (Araneae: Archaeidae) in the Australian mesic zone: Evidence for Miocene speciation within Tertiary refugia. Molecular Phylogenetics and Evolution, 62(1), 375-396.
https://doi.org/10.1016/j.ympev.2011.10.009
Rodríguez-Vera, B. H. (2012). Caracterización morfológica y distribución geográfica de Heterophrynus batesii (Butler, 1873) (Amblypygi: Phrynidae) en Colombia. (Tesis de grado). Bogotá, D. C.: Universidad Nacional de Colombia.
Román-Valencia, C., Arcila-Mesa, D. K. & Hurtado-T, H. (2009). Variación morfológica de los peces Hemibrycon boquiae y Hemibrycon rafaelense (Characiformes: Characidae) en el Río Cauca, Colombia. Revista de Biología Tropical, 57(3), 541-556.
https://doi.org/10.15517/rbt.v57i3.5474
Ruiz-C., R. I., Román-Valencia, C., Herrera-M., B. E., Peláez, O. E. & Ermakova-A, A. (2011). Variación morfológica de las especies de Astyanax, subgénero Zygogaster (Teleostei, Characidae). Animal Biodiversity and Conservation, 34(1), 47-66.
Salgado‐Roa, F. C., Pardo‐Díaz, C., Lasso, E., Arias, C. F., Solferini, V. N. & Salazar, C. (2018). Gene flow and Andean uplift shape the diversification of Gasteracantha cancriformis (Araneae: Araneidae) in Northern South America. Ecology and evolution, 8(14), 7131-7142.
https://doi.org/10.1002/ece3.4237
Shultz, J. W. (1999). Muscular anatomy of a whip spider Phrynus longipes (Pocock) (Arachnida: Amblypygi), and its evolutionary significance. Zoological Journal of the Linnean Society, 126(1), 81-116.
https://doi.org/10.1111/j.1096-3642.1999.tb00608.x
Suzuki, S. (1974). The Japanese species of the genus Sabacon (Arachnida, Opiliones, Ischyropsalididae).Journal of science of the Hiroshima University, Series B, Division 1, Zoology, 25,83-108.
Torres, R. A., Atencia, P. L. & Liria, J. (2018). Morphogeometric variation in Phrynusbarbadensis(Pocock, 1893)(Amblypyghi: Phrynidae) from Colombia. Revista de la Sociedad Entomológica Argentina, 77(1), 18-23.
https://doi.org/10.25085/rsea.770103
van Der Hammen, T. (1995).Global change, biodiversity and conservation of Neotropical montane forests. En Churchill, S. P., H.Balslevy, E. Forero. (Eds.). Biodiversity and conservation of neotropical montane forests: proceedings of the Neotropical montane forest biodiversity and conservation symposium. Pp: 702. New York: The New York Botanical Garden.
Vasconcelos, A. C. O., Giupponi, A. D. L. & Ferreira, R. L.(2013). A new species of Charinus Simon, 1892 from northeastern Brazil with comments on the potential distribution of the genus in Central and South Americas (Arachnida: Amblypygi: Charinidae). Zootaxa, 3737(4), 488-500.
https://doi.org/10.11646/zootaxa.3737.4.9
Víquez, C., Chiriví-Joya, D. A., Moreno-González, J. A. & Christensen, J. A. (2014). Heterophrynus armiger Pocock, 1902 (Amblypygi: Phrynidae): First record from Colombia, with notes on its historic distribution records and natural history. Check List, 10(2), 457-460.
https://doi.org/10.15560/10.2.457
Weygoldt, P. (1974). Comparative studies on two Heterophrynus (Admetus) species, Heterophrynus longicornis Butler and Heterophrynus batesii Butler (Arachnida, Amblypygi, Tarantulidae). Zoologischer Anzeiger, Journal of Comparative Zoology, 192(2), 175-191.
Weygoldt, P. (2000). Whip spider (Chelicerata: Amblypygi). Their Biology, Morfology and Systematics. Denmark: Apollo Books.
Wickham, H. (2016). Ggplot2: elegant graphics for data analysis. Springer.
https://doi.org/10.1007/978-3-319-24277-4
Williams, G. (2011). Data mining with Rattle and R: The art of excavating data for knowledge discovery.Sydney, Australia:Springer Science & Business Media.
Anexo 1. Material examinado de Heterophrynus boterorum en los análisis estadísticos. H= hembra, M= macho.
Anexo 2. Promedios de medidas y conteos realizados en ejemplares de Heterophrynus boterorum para las poblaciones de las localidades en los Andes Centrales de Colombia; Quindío= Armenia, Calarcá, Circasia, Córdoba, Filandia y Salento, por efectos prácticos de visualización todas estas localidades en Quindío.
Referencias
Álvarez-García, D. M., Armas, L. F. & Díaz-Pérez, J. A. (2015). Una especie nueva de Heterophrynus (Amblypygi: Phrynidae) del nordeste de Colombia. Revista Ibérica de Aracnología, 27, 45-49.
Armas, L. F., Chiriví-Joya, D., Botero-Trujillo, R., Camacho-Cortés, G. P. & García, S. (2012). Presencia en Colombia de la familia Charinidae (Arachnida: Amblypygi). Boletín de la Sociedad Entomológica Aragonesa, 50, 321-322.
Armas, L. F., Delgado-Santa, L. & García-Cárdenas, D. R. (2013). Primer registro de Heterophrynus boterorum Giupponiy & Kury, 2013 (Amblypygi: Phrynidae) para el departamento de Quindío, Colombia. Revista Ibérica de Aracnología, 23, 115-116.
Armas, L. F., Torres-Contreras, R. & Álvarez-García, D. M. (2015). Nueva especie de Heterophrynus (Amblypygi: Phrynidae) del Caribe Colombiano. Revista Ibérica de Aracnología, 26, 69-73.
Carrillo, P. & Ivveth, K. (2012). Variación morfológica y genética de Tamarixia radiata (Waterston) (Hymenoptera: Eulophidae) en los estados de Colima, Nuevo León, Tamaulipas y Michoacán, México. (Tesis de grado). Nuevo León, México: Universidad Autónoma de Nuevo León.
Chiriví, D. A. & Armas, L. F. (2012). La subfamilia Phryninae (Amblypygi: Phrynidae) en Colombia. Boletín de la Sociedad Entomológica Aragoneza, 50, 395-402.
De-Silva, D. L., Chazot, N., Silva, K. L., Lamas, G., Mallet, J., Willmott, K. R. & Elias, M. (2017). Origen del norte de los Andes y diversificación del género más grande de mariposa Ithomiine. Informes científicos, 7, 45966.
Díaz, S., Panzera, F., Jaramillo-O, N., Pérez, R., Fernández, R., Vallejo, G. & Gómez-Palacio, A. (2014). Genetic, cytogenetic and morphological trends in the evolution of the Rhodnius (Triatominae: Rhodniini) trans-Andean group. PLoSOne, 9(2), e87493.
https://doi.org/10.1371/journal.pone.0087493
Duran, L. G. (1956).Historia geológica de Colombia. Revista de la Academia Colombiana de Ciencias, 43, 137-191.
Esposito, L. A., Bloom, T., Caicedo-Quiroga, L., Alicea-Serrano, A. M.,Sánchez-Ruíz, J. A., May-Collado, L. J., Binford, G. J. & Agnarsson,I. (2015). Islands within islands: Diversification of tailless whip spiders (Amblypygi, Phrynus) in Caribbean caves. Molecular Phylogenetics and Evolution, 93, 107-117.
https://doi.org/10.1016/j.ympev.2015.07.005
Ferretti, N., González,A. & Pérez-Miles,F. (2011). Historical biogeography of the genus Cyriocosmus (Araneae: Theraphosidae) in the Neotropics according to an event-based method and spatial analysis of vicariance. Zoological Studies, 51(4), 526-535.
Fox, J. & Weisberg, S. (2011). An R Companion to Applied Regression. Second edition. Thousand Oaks, USA: Sage Publications Inc.
Fox, J. (2016).Using the R Commander: A Point-and-Click Interface for R. Ontario, Canadá: Chapman and Hall/CRC Press.
https://doi.org/10.1201/9781315380537
Futuyma, D. J. (1998). Evolutionary Biology. Third Edition. New York: SUNY, Stony Brook.
Gentry, A. (1982). Neotropical floristic diversity: phytogeographical connections between Central and South America, pleistocene climatic fluctuation or an ancient of the Andean orogeny. Annals of theMissouri Botanical Garden, 69(3), 557-593.
https://doi.org/10.2307/2399084
Giupponi, A. L. P. & Kury,A. B. (2013).Two new species of Heterophrynus Pocock, 1894 from Colombia with distribution notes and a new synonymy (Arachnida: Amblypygi: Phrynidae). Zootaxa, 3647(2), 329-342.
https://doi.org/10.11646/zootaxa.3647.2.5
Gómez-Cuervo, A., Pérez-Consuegra, N. & Lamus-Ochoa, F.(2015). Levantamiento de la Cordillera Oriental de los Andes colombianos. Hipótesis, Apuntes Científicos Uniandinos, 19, 66-73.
Hedin, M. & Thomas, S. M. (2010). Molecular systematics of eastern North American Phalangodidae (Arachnida: Opiliones: Laniatores), demonstrating convergent morphological evolution in caves. Molecular Phylogenetics and Evolution, 54(1), 107-121.
https://doi.org/10.1016/j.ympev.2009.08.020
Heiberger, R. M., Freeny, A. E. & Chambers, J. M. (2017). Analysis of variance; designed experiments. En Chambers, J. M. & Hastie, T.J.(Eds). Statistical models in S. Pp. 145-193. Londres, Inglaterra: Routledge.
https://doi.org/10.1201/9780203738535-5
Hollander, M. & Wolfe,D. A. (1973).Nonparametric Statistical Methods. Second edition. New York: John Wiley & Sons.
Holdridge, L. R. (1947). Determination of world plant formations from simple climatic data. Science, 105(2727), 367-368.
https://doi.org/10.1126/science.105.2727.367
Holdridge, L. R. (1967). Life zone ecology. San José, Costa Rica: Tropical Science Center.
Igelmund, P. (1987). Morphology, sense organs, and regeneration of the forelegs (whips) of the whip spider Heterophrynus elaphus (Arachnida, Amblypygi). Journal of Morphology, 193(1), 75-89.
https://doi.org/10.1002/jmor.1051930108
Kraus, O. (2000). Why no subspecies in spiders? European Arachnology, 2000, 303-314.
Lobo-Guerrero, A. (1999). Infraestructura de Colombia. En Memorias V Congreso Colombiano de Geotecnia y Medio Ambiente. Bogotá, D.C.
Miller, M. J., Bermingham, E., Klicka, J., Escalante, P., Do Amaral, F. S. R., Weir, J. T. & Winker, K. (2008). Out of Amazonia again and again: episodic crossing of the Andes promotes diversification in a lowland forest flycatcher. Proceedings of the Royal Society B: Biological Sciences, 275(1639), 1133-1142.
https://doi.org/10.1098/rspb.2008.0015
Mills, S., Lunt, D. H. & Gómez, A. (2007). Global isolation by distance despite strong regional phylogeography in a small metazoan. BMC Evolutionary Biology, 7(1), 225.
https://doi.org/10.1186/1471-2148-7-225
Oksanen, J. (2013). Vegan: ecological diversity. https://cran.r-project.org/web/packages/vegan/vignettes/diversity-vegan.pdf (consultado 12 de agosto 2019).
Prendini L., (2001). Substratum specialization and speciation in Southern African scorpions: the Effect Hypothesis revisited. En: Fet V. and Selden P. A. (eds.). Scorpions 2001. In Memoriam Gary A. Polis (pp. 113-138). Inglaterra: British Arachnological Society, Burnham Beeches, Bucks.
Prendini, L., Weygoldt,P. & Wheelera,W. C. (2005). Systematics of the Damon variegatus group of African whip spiders (Chelicerata: Amblypygi): Evidence from behaviour, morphology and DNA. Organisms, Diversity & Evolution, 5(3), 203-236.
https://doi.org/10.1016/j.ode.2004.12.004
Punzo, F. & Reeves,C. (2001). Geographical variation in male courtship behaviour of the giant whipscorpion Mastigoproctus giganteus (Lucas) (Arachnida, Uropygi). Bulletin British Arachnological Society, 12(2), 93-96.
Quintero, D. (1981). The amblypygid genus Phrynus in the Americas (Amblypygi, Phrynidae). Journal Arachnology, 9(2), 117-166.
R Development Core Team. (2012). R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing.
Rix, M. G. & Harvey, M. S. (2011). Phylogeny and historical biogeography of ancient assassin spiders (Araneae: Archaeidae) in the Australian mesic zone: Evidence for Miocene speciation within Tertiary refugia. Molecular Phylogenetics and Evolution, 62(1), 375-396.
https://doi.org/10.1016/j.ympev.2011.10.009
Rodríguez-Vera, B. H. (2012). Caracterización morfológica y distribución geográfica de Heterophrynus batesii (Butler, 1873) (Amblypygi: Phrynidae) en Colombia. (Tesis de grado). Bogotá, D. C.: Universidad Nacional de Colombia.
Román-Valencia, C., Arcila-Mesa, D. K. & Hurtado-T. H. (2009). Variación morfológica de los peces Hemibrycon boquiae y Hemibrycon rafaelense (Characiformes: Characidae) en el Río Cauca, Colombia. Revista de Biología Tropical, 57(3), 541-556.
https://doi.org/10.15517/rbt.v57i3.5474
Ruiz-C., R. I., Román-Valencia, C., Herrera-M., B. E., Peláez, O. E. & Ermakova-A., A. (2011). Variación morfológica de las especies de Astyanax, subgénero Zygogaster (Teleostei, Characidae). Animal Biodiversity and Conservation, 34(1), 47-66.
Salgado‐Roa, F. C., Pardo‐Díaz, C., Lasso, E., Arias, C. F., Solferini, V. N. & Salazar, C. (2018). Gene flow and Andean uplift shape the diversification of Gasteracantha cancriformis (Araneae: Araneidae) in Northern South America. Ecology and Evolution, 8(14), 7131-7142.
https://doi.org/10.1002/ece3.4237
Shultz, J. W. (1999). Muscular anatomy of a whipspider Phrynus longipes (Pocock) (Arachnida: Amblypygi), and its evolutionary significance. Zoological Journal of the Linnean Society, 126(1), 81-116.
https://doi.org/10.1111/j.1096-3642.1999.tb00608.x
Suzuki, S. (1974). The Japanese species of the genus Sabacon (Arachnida, Opiliones, Ischyropsalididae). Journal of science of the Hiroshima University, Series B, Division 1, Zoology, 25,83-108.
Torres, R. A., Atencia, P. L. & Liria,J. (2018). Morphogeometric variation in Phrynus barbadensis (Pocock, 1893) (Amblypyghi: Phrynidae) from Colombia. Revista de la Sociedad Entomológica Argentina, 77(1), 18-23.
https://doi.org/10.25085/rsea.770103
van Der Hammen, T. (1995).Global change, biodiversity and conservation of Neotropical montane forests.En Churchill, S. P., H. Balslev y E. Forero. (Eds.). Biodiversity and conservation of neotropicalmontane forests: proceedings of the Neotropical montane forest biodiversity and conservation symposium. Pp: 702. New York: The New York Botanical Garden.
Vasconcelos, A. C. O., Giupponi, A. D. L. & Ferreira, R. L. (2013). A new species of Charinus Simon, 1892 from northeastern Brazil with comments on the potential distribution of the genus in Central and South Americas (Arachnida: Amblypygi: Charinidae). Zootaxa, 3737(4), 488-500.
https://doi.org/10.11646/zootaxa.3737.4.9
Víquez, C., Chiriví-Joya, D. A., Moreno-González, J. A. & Christensen, J. A. (2014). Heterophrynus armiger Pocock, 1902 (Amblypygi: Phrynidae): First record from Colombia, with notes on its historic distribution records and natural history. Check List, 10(2), 457-460.
https://doi.org/10.15560/10.2.457
Weygoldt, P. (1974). Comparative studies on two Heterophrynus (Admetus) species, Heterophrynus longicornis Butler and Heterophrynus batesii Butler (Arachnida, Amblypygi, Tarantulidae). Zoologischer Anzeiger, Journal of Comparative Zoology, 192(2), 175-191.
Weygoldt, P. (2000). Whip spider (Chelicerata: Amblypygi). Their Biology, Morfology and Systematics. Denmark: Apollo Books.
Wickham, H. (2016). Ggplot2: elegant graphics for data analysis. New York: Springer.
https://doi.org/10.1007/978-3-319-24277-4
Williams, G. (2011). Data mining with Rattle and R: The art of excavating data for knowledge discovery.Sydney, Australia: Springer Science & Business Media.
Cómo citar
Las obras publicadas en las revistas del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt están sujetas a los siguientes términos, con relación al derecho de autor:
1. Los derechos patrimoniales de las obras publicadas tienen como titular al Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Los autores o las instituciones que elaboran el documento aceptan ceder los derechos patrimoniales al Instituto Humboldt con el envío de sus artículos, lo que permite –entre otras cosas– la reproducción, comunicación pública, difusión y divulgación de las obras.
2. Las obras de ediciones digitales se publican bajo una licencia de Creative Commons Colombia:
Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional.
Atribución – No comercial – Sin Derivar: Esta licencia es la más restrictiva de las seis licencias principales, sólo permite que otros puedan descargar las obras y compartirlas con otras personas, siempre que se reconozca su autoría, pero no se pueden cambiar de ninguna manera ni se pueden utilizar comercialmente.
3. Los autores, al someter artículos al proceso editorial de las revistas editadas por el Instituto Humboldt, aceptan las disposiciones institucionales sobre derechos de autor y acceso abierto.
4. Todos los artículos recibidos serán sometidos a un software antiplagio. El sometimiento de un artículo a las revistas del Instituto Humboldt se entiende como la aceptación de la revisión para detectar posible plagio.
5. Las obras sometidas al proceso de edición de las revistas del Instituto Humboldt deben ser inéditas.




















