Abstract (en):
Six functional traits of the stem and leaves of species with basal diameters greater than or equal to 5 cm were measured in eight permanent plots with successional shrub coverings, in the Eastern Cordillera of Colombia, in order to describe the functional traits of the species. For each trait, distribution frequencies and correlations were obtained, and used to determine acquisitive and conservative strategies. Most of the 45 species recorded had small leaves, low specific leaf area, low maximum photosyntetic assimilation and low maximum height; wood density was centered on the median of the distribution. There was no correlation among leaf traits, wood density and maximum height,. Nine species had acquisitive traits, with high rates of maximum photosyntetic assimilation, high specific leaf area, low leaf dry matter content, and low wood density. On the contrary, 36 species with conservative traits, showed low rates of maximum photosyntetic assimilation, low specific leaf area, high leaf dry matter content and average wood density.
Abstract (es):
Se midieron seis rasgos funcionales del tallo y hoja de especies que tuvieran diámetros basales mayores o iguales a 5 cm, en ocho parcelas permanentes con coberturas arbustivas sucesionales, en la Cordillera Oriental de Colombia, para describir sus comportamientos funcionales. Para cada rasgo se obtuvieron frecuencias de distribución y correlaciones que permitieron determinar estrategias de tipo adquisitivo y conservativo. La mayoría de las 45 especies registradas tenían hojas pequeñas, área foliar específica baja, asimilación fotosintética máxima baja y altura máxima baja; la densidad de madera más frecuente estaba centrada en la mediana de la distribución. No hubo correlación entre los rasgos foliares y la densidad de madera o la altura máxima. Nueve especies tenían rasgos adquisitivos, con altas tasas de asimilación fotosintética máxima, alta área foliar específica, bajo contenido foliar de materia seca y baja densidad de madera. Por el contrario, 36 especies con rasgos conservativos mostraron bajas tasas de asimilación fotosintética máxima, baja área foliar específica, alto contenido foliar de materia seca y densidad de madera media.
Keywords:
Leaf traits, Maximum photosynthetic assimilation, Wood density (en)
https://doi.org/10.21068/2539200X.1008
Relaciones entre rasgos funcionales de plantas en bosques secundarios altoandinos de la Cordillera Oriental, Colombia
Functional traits relationships of plants in secondary forests andean of the Eastern Cordillera, Colombia
Luis Gabriel López Herrera
 1
1
Recibido: 31 de mayo 2021
Aceptado: 29 de marzo 2022
Citación: López-Herrera, L. G. (2022). Relaciones entre rasgos funcionales de plantas de bosques secundarios altoandinos de la Cordillera Oriental, Colombia. Biota Colombiana, 23(2), e1008.
Resumen
Se midieron seis rasgos funcionales del tallo y hoja de especies que tuvieran diámetros basales mayores o iguales a 5 cm, en ocho parcelas permanentes con coberturas arbustivas sucesionales, en la Cordillera Oriental de Colombia, para describir sus comportamientos funcionales. Para cada rasgo se obtuvieron frecuencias de distribución y correlaciones que permitieron determinar estrategias de tipo adquisitivo y conservativo. La mayoría de las 45 especies registradas tenían hojas pequeñas, área foliar específica baja, asimilación fotosintética máxima baja y altura máxima baja; la densidad de madera más frecuente estaba centrada en la mediana de la distribución. No hubo correlación entre los rasgos foliares y la densidad de madera o la altura máxima. Nueve especies tenían rasgos adquisitivos, con altas tasas de asimilación fotosintética máxima, alta área foliar específica, bajo contenido foliar de materia seca y baja densidad de madera. Por el contrario, 36 especies con rasgos conservativos mostraron bajas tasas de asimilación fotosintética máxima, baja área foliar específica, alto contenido foliar de materia seca y densidad de madera media.
Palabras clave. Asimilación fotosintética máxima. Densidad de madera. Rasgos foliares.
Abstract
Six functional traits of the stem and leaves of species with basal diameters greater than or equal to 5 cm were measured in eight permanent plots with successional shrub coverings, in the Eastern Cordillera of Colombia, in order to describe the functional traits of the species. For each trait, distribution frequencies and correlations were obtained, and used to determine acquisitive and conservative strategies. Most of the 45 species recorded had small leaves, low specific leaf area, low maximum photosyntetic assimilation and low maximum height; wood density was centered on the median of the distribution. There was no correlation among leaf traits, wood density and maximum height,. Nine species had acquisitive traits, with high rates of maximum photosyntetic assimilation, high specific leaf area, low leaf dry matter content, and low wood density. On the contrary, 36 species with conservative traits, showed low rates of maximum photosyntetic assimilation, low specific leaf area, high leaf dry matter content and average wood density.
Key words. Leaf traits. Maximum photosynthetic assimilation. Wood density.
Introducción
Los bosques secundarios se han convertido en una de las mayores extensiones forestales en el mundo (OIMT, 2006), en refugio para la biodiversidad y en alternativa para el aprovisionamiento de bienes y servicios para el ser humano ( FAO, 2012; Wadsworth, 1997). Muchas de las especies que se encuentran en bosques secundarios tempranos tienen rasgos funcionales similares (Chazdon & Montgomery, 2002). Un rasgo funcional es un carácter morfológico, fisiológico o fenológico, relevante ecológicamente para comprender y explicar la relación de una planta con su entorno abiótico y biótico (Cornelissen et al., 2003; Lavorel & Garnier, 2002).
Se ha demostrado que especies pioneras de bosques sucesionales, suelen presentar baja densidad de madera, altas tasas de crecimiento (Aquino, 2009) y una capacidad muy alta de fijar carbono atmosférico (Fearnside & Guimaraes, 1996), proceso que se realiza a través de las hojas (Chazdon & Coe 1999). La manera como una especie invierte y distribuye los recursos a diferentes partes de las células, tejidos y órganos vegetales es conocida como estrategia (Freschet et al., 2010). La asignación de recursos a las hojas varía considerablemente de una especie a otra (Chazdon, 1992) y se ha determinado que hay especies que tienen rasgos relacionados con estrategias adquisitivas (Grime et al., 1997; Reich et al., 1999; Ruíz & Villar 2005) y otras especies tienen estrategias conservativas (Hobbie, 1992; Aerts, 1995).
Las especies con estrategias adquisitivas son aquellas que tienen la capacidad de asimilar recursos rápidamente y tienen un crecimiento acelerado. Sin embargo, son especies que tienden a tener baja supervivencia en condiciones de baja disponibilidad de recursos (Kitajima, 1994). La mayoría de plantas adquisitivas muestran rasgos con bajos valores en densidad de madera (DM), pero altos contenidos de nitrógeno, fósforo y área foliar específica (AFE), así como alta asimilación máxima, Amax (Ruíz & Villar, 2005; Fernández, 2007). Por otro lado, las plantas con estrategias conservativas generalmente tienen bajas tasas de asimilación de recursos y un crecimiento lento, pero a diferencia de las adquisitivas, presentan mejor supervivencia en condiciones desfavorables. Se ha encontrado que estos tipos de plantas muestran altos valores en el contenido foliar de materia seca (CFMS), bajos contenidos de N y P, baja AFE y alta DM (Fernández, 2007; De la Riva et al., 2014).
De manera progresiva se ha venido demostrando que existe correlación entre rasgos. A nivel foliar, Wright et al. (2004) mostraron que existe un espectro mundial de economía foliar, al observar que en 2548 especies de 175 sitios, seis rasgos de hoja covariaban fuertemente, sugiriendo patrones en el uso de los recursos. Adicionalmente, Moles y Westoby (2006) encontraron que había relación positiva entre la altura de un individuo, la masa de sus semillas y el porcentaje de supervivencia de las plántulas en la sombra. En contraste, Wright et al. (2007) evidenciaron que no había relaciones de rasgos foliares con densidad de la madera, lo que lleva a pensar que estos rasgos actúan de manera independiente, pero su análisis en conjunto permite identificar estrategias de las especies para desempeñarse en el medio. Fernández (2007) definió cinco tipos funcionales de plantas mediante el análisis de rasgos foliares y de densidad de madera, encontrando dos grupos de plantas contrastantes entre sí, a las que clasificó como conservativas y adquisitivas.
Con esta investigación se busca conocer y analizar aspectos preliminares del desempeño funcional de la vegetación en estado sucesional temprano en el altiplano cundiboyacense, a través de la medición de rasgos funcionales. Se busca entender el funcionamiento de este tipo de cobertura, información que puede ser útil en medidas de manejo y restauración.
Materiales y métodos
Área de Estudio. El estudio se llevó a cabo en ocho parcelas permanentes de 400 m2 establecidas en el altiplano cundiboyacense de Colombia, entre las coordenadas 04°48’N - 74° 01’ O y 4° 56’ N - 73° 53’ O, entre 2539 y 3093 m s.n.m., en los municipios de Guatavita, Tabio, Guasca y al norte de Bogotá, en la localidad de Torca (Tabla 1). La temperatura media anual oscila entre 14 ºC y 13.6 ºC. La precipitación es bimodal con la primera estación de lluvias de abril a mayo, y la segunda de septiembre a diciembre (IDEAM, 2008).
Las coberturas de las cuatro zonas de estudio corresponden a estados de sucesión temprana, compuesta por especies arbustivas heliófilas de porte bajo. La única excepción fue la parcela Encenillo 3 que se estableció en un bosque secundario tardío dominado por Weinmannia tomentosa, en la Reserva Natural El Encenillo.
Tabla 1. Unidades de monitoreo permanente usadas para la evaluación de los rasgos funcionales de plantas, en la Cordillera Oriental de Colombia.
Table 1. Permanent monitoring units used for evaluating plant functional traits in the Eastern Cordillera of Colombia.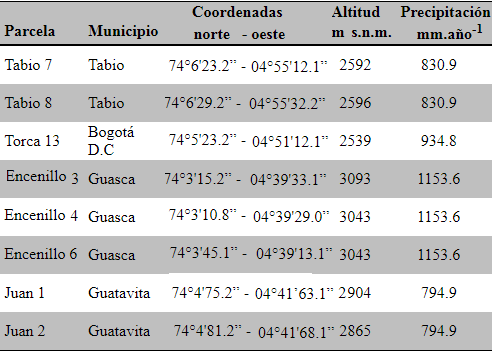
Todos los individuos con diámetro basal superior a 5 cm fueron marcados e identificados a nivel de especie. Los rasgos medidos fueron: el área foliar (AF, mm2), el área foliar especifica (AFE, cm2.g-1), el contenido foliar de materia seca (CFMS, g peso seco.g peso húmedo-1), la asimilación fotosintética máxima (Amax, nm g-1.s-1), la densidad de madera (DM, g.cm-3)-1 y la altura máxima de las plantas; esta última se obtuvo con base en revisión de la literatura.
Caracterización de los rasgos foliares. A cinco individuos de cada una de las 45 especies (Tabla 2), se les cosecharon cinco hojas de distintas ramas por individuo, siguiendo el protocolo estándar para toma de muestras foliares (Cornelissen et al., 2003). Las hojas eran sanas, sin herbivoría y estaban plenamente expuestas al sol. Cada hoja se empacó en una bolsa plástica resellable, con papel absorbente altamente humedecido y se almacenó en una nevera a 4 ºC por un máximo de 24 horas. Luego, en el laboratorio cada hoja fue pesada (peso fresco) en una balanza analítica digital con precisión a 0.0001 g (Adams PW-254, Estados Unidos) y después fue escaneada a una resolución de 600 dpi, con un escáner (HP Scanjet 64 050, CA, Estados Unidos). La imagen se procesó con el programa ImageJ (versión 1.44 University of Wisconsin at Madison, Estados Unidos) y de allí se obtuvo el área foliar. Las hojas grandes, como las de Oreopanax bogotensis, se dividieron en secciones y se sumaron las fracciones (Cornelissen et al., 2003). El peso seco se obtuvo luego de secar las muestras a 60 ºC hasta peso constante en un horno (Quincy Lab, Inc. 40 GC, Estados Unidos).
El contenido foliar de materia seca se calculó como la relación entre el peso seco y el peso fresco de cada hoja completamente hidratada, mientras que el área foliar especifica se determinó como la relación entre el área foliar, incluyendo el peciolo, y su peso seco. Para la medición de la tasa de fotosíntesis neta máxima de las hojas se recolectaron tres ramas del dosel de tres individuos por cada especie, en las primeras horas del día y durante días lluviosos (diciembre 2016 y mayo 2018). Una vez recolectadas, las ramas se sumergieron inmediatamente en agua y los tallos volvieron a cortarse para evitar la formación de embolismos.
Todas las hojas estaban plenamente expandidas, no tenían daños por herbivoría, necrosis o daños mecánicos. Amax se midió utilizando un analizador de gases en el infrarojo (LiCor, LI-6400XT) equipado con una luz roja-azul (LiCor, 6400-02B); la concentración de CO2 y la temperatura no se controlaron y correspondieron a las del ambiente. Para evitar grandes variaciones en las concentraciones de CO2 atmosférico, el aire que entraba al sistema pasaba primero por recipientes de gran volumen. Cada una de las hojas muestreadas fue sometida a crecientes intensidades de luz (700, 1500 y 1800 µmol m-2·s-1) con el fin de inducir la activación de la maquinaria fotosintética.
El valor de Amax se obtuvo seleccionando la mayor tasa de fotosíntesis, siempre y cuando la concentración interna de CO2 (Ci) estuviera entre 200 y 330 ppm. En algunas especies con hojas extremadamente pequeñas, como Diplostephium rosmarinifolium y Ulex europaeus, no fue posible obtener el valor de Amax, ya que se estaba operando muy cerca del nivel de detección de CO2 del equipo.
Densidad de madera. Para la determinación de este rasgo se seleccionaron en el campo tres individuos por cada especie, que fueron barrenados a 30 cm arriba de donde se midió el diámetro basal (Cornelissen et al., 2003), usando un barrenador de 5.15 mm de diámetro (Incremental Borer Haglöf Sweden, Suecia), con el cual se tomaron muestras de 4-8 cm de largo. El volumen verde fue calculado con el método de inmersión y posteriormente las muestras fueron secadas al horno a 103 oC (Quincy Lab, Inc. 40 GC, Estados Unidos), durante 24 horas y pesadas en una balanza analítica digital con precisión a 0.0001 g.
Altura máxima. Este rasgo se obtuvo mediante la revisión de especímenes en la base de datos del Herbario Nacional Colombiano y en publicaciones sobre especies de la región (Mahecha, 2012). En la medida de lo posible, se seleccionaron los datos de individuos que hubieran sido recolectados bajo las mismas condiciones climáticas que las de nuestra área de estudio. En caso de tener varios registros de altura se seleccionó el valor más alto.
Análisis. Cada rasgo funcional se promedió para cada especie. Las especies se clasificaron por tamaño de hoja con base en las categorías propuestas por Webb, 1959), de la siguiente forma: nanofilas (25-225 mm2) y microfilas (225-2025 mm2), notofilas (2025- 4500 mm2), mesofilas (4500-18 225 mm2), macrofilas (18 225-164 025 mm2) y megafilas (>164 025 mm2).
Adicionalmente se estimó la variabilidad en los rasgos, utilizando coeficientes de variación (CV) con los valores medios de cada rasgo por especie. También se hicieron análisis de medidas de distribución, de correlación de Pearson, entre los seis rasgos medidos para sus valores log-transformados, con un valor crítico de significación estadística de P ≤ 0.05 y análisis de componentes principales. Los análisis estadísticos se hicieron con SPSS Statistics base 22 (IBM Corporation © Copyright IBM, Estados Unidos).
Resultados
Aunque se observó una gran variabilidad en la composición de especies entre las zonas de estudio, algunas de las especies globalmente más dominantes fueron Vallea stipularis Macleania rupestris, Cavendishia bracteata y Weinmannia tomentosa.
Los resultados de la composición florística de la vegetación muestreada y valores promedio de los seis rasgos funcionales medidos se presentan en la Tabla 2. De las 45 especies evaluadas, tres presentan hojas nanofilas, veinticuatro hojas microfilas, nueve hojas notofilas, ocho mesofilas, una macrofila y no hubo megafilas.
La distribución de frecuencias de los rasgos (Figura 1), presentó diferentes tipos de distribución para cada uno. Los rasgos AF (a) AFE (c) Amax (d) y Hmax (f) mostraron distribución asimétrica hacia la izquierda de la media, en donde se alojan los valores inferiores para los rasgos.
Tabla 2. Composición florística de la vegetación en ocho parcelas de la Cordillera Oriental de Colombia, y valores promedio de área foliar (AF), contenido foliar promedio de materia seca (CFMS), área foliar específica (AFE) asimilación máxima (Amax), densidad de madera (DM) y altura máxima (H max). Las especies están dispuestas en orden descendente de área foliar.
Table 2. Floristic composition of the vegetation in eight plots at the Eastern Cordillera of Colombia, and average values of leaf area (AF), average leaf dry matter content (CFMS), specific leaf area (AFE), assimilation maximum (Amax), wood density (MD) and maximum height (H max). Species are arranged in decreasing order of leaf area.
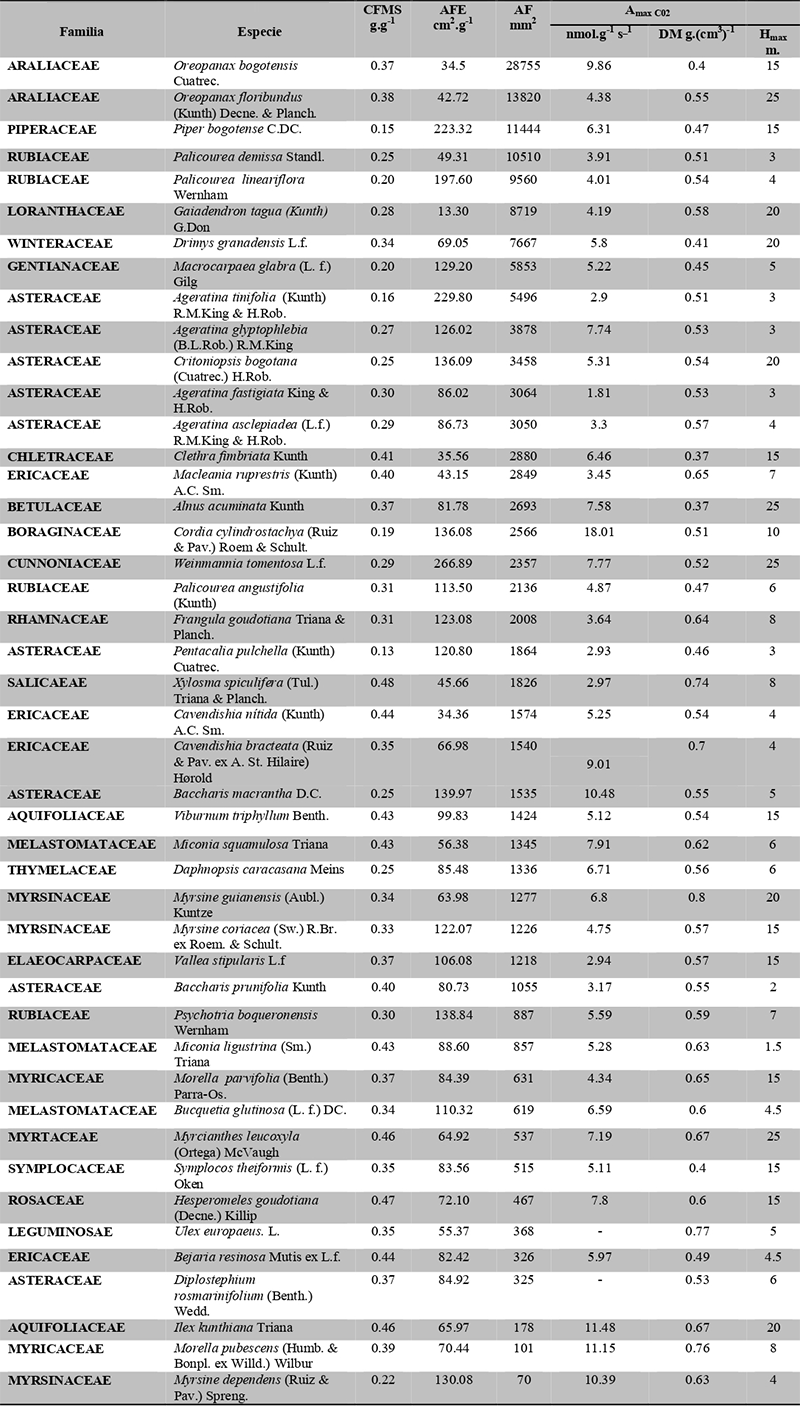
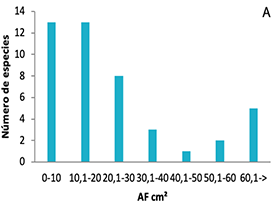
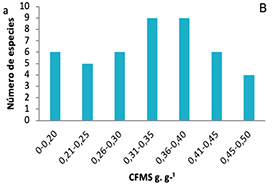
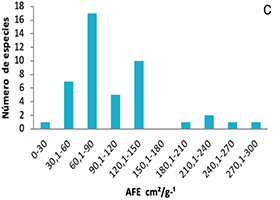
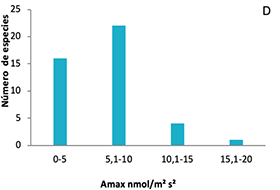
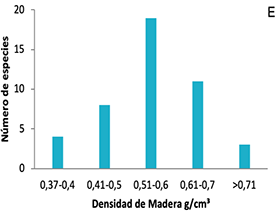
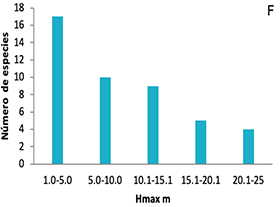
Figura 1. Frecuencias de distribución de los rasgos funcionales de plantas en ocho parcelas en la Cordillera Oriental de Colombia. A, área foliar (AF); B, contenido foliar de materia seca (CFMS); C, área foliar específica (AFE); D, asimilación máxima (Amax); E, densidad de madera (DM); F, altura máxima (Hmax).
Figure 1. Distribution frequencies of plant functional traits in eight plots on the Eastern Cordillera of Colombia. A, leaf area (AF); B, leaf dry matter content (CFMS); C, specific leaf area (AFE); D, maximum assimilation (Amax); E, wood density (DM); F, maximum height (Hmax).
En el caso del AF, el 73 % de especies tenían hojas con superficies por debajo de los 3000 mm2 (equivalente a un cuadrado 58.4 x 58.4 mm) y tan solo 4 % tenían áreas promedio ligeramente superiores a 10 000 mm2 (100 x 100 mm).
Para el AFE se evidencia una mayor frecuencia de especies con valores bajos de 60.1 a 90 cm2.g-1. Las especies que presentaron los mayores valores fueron Piper bogotense y Weinmannia tomentosa, contrastadas con las de menor valor como Gaiadendron tagua y Cavendisha nítida. Se observa además la alta frecuencia de especies de porte bajo que no sobrepasan los 5 m. de altura máxima, y solo cuatro especies tuvieron una altura máxima superior a 20.1 m.
A diferencia de los anteriores rasgos, la distribución de frecuencias para los rasgos CFMS (Figura 1C) y DM (Figura 1E) tiende a ser normal, aunque de tipo leptocúrtica y platicúrtica, con un modo amplio centrado alrededor de la media. Las familias Salicaceae, Rosaceae, Aquifoliaceae y Ericaceae fueron las de mayores CFMS, mientras que las familias Asteraceae y Piperaceae tuvieron las especies con menor CFMS.
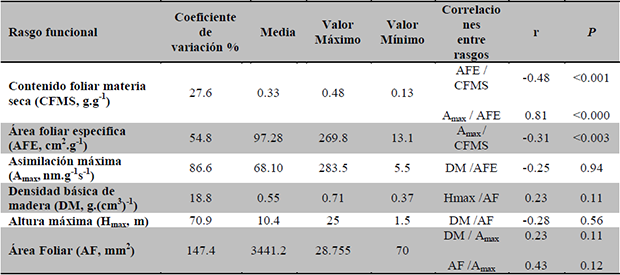
Relación entre rasgos foliares. Se presentaron correlaciones significativas entre AFE y CFMS, Amax y CFMS, y Amax y AFE. El AF no estuvo significativamente relacionada con CFMS, ni con Amax. Los rasgos relacionados a nivel de tallo no presentaron ninguna correlación con los rasgos foliares (Tabla 3).
Tabla 3. Estadística descriptiva y correlaciones entre rasgos funcionales evaluados para 45 especies de plantas en ocho parcelas en la Cordillera Oriental de Colombia.
Table 3. Descriptive statistics and correlations between functional traits evaluated for 45 plant species in eitght plots at the Eastern Cordillera of Colombia.
El análisis de componentes principales (ACP) realizado con los seis rasgos funcionales, explicó para los dos primeros ejes el 55.87 % de la variabilidad. En el análisis de los ejes se observa cómo en estos ecosistemas se conforman dos grupos de rasgos funcionales. El primero, conformado por los rasgos AFE, AF, Amax (masa), separados del CFMS; y el segundo, por la DM, separado de la Hmax. (Figura 2). Además, con este análisis se evidencia que los rasgos CFMS, AFE, DM y Hmax son los que más distinguen funcionalmente a las especies en estas coberturas.
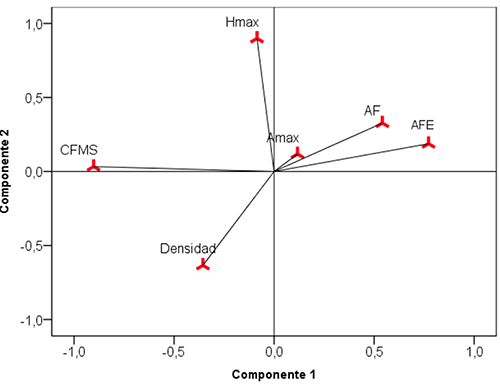
Figura 2. Análisis de componentes principales de los rasgos funcionales densidad de madera (DM), contenido foliar de materia seca (CFMS), área foliar (AF), área foliar específica (AFE), asimilación máxima (Amax) y altura máxima (Hmax) en ocho parcelas en la Cordillera Oriental de Colombia.
Figure 2. Principal component analysis of the functional features wood density (DM), foliar content of dry matter (CFMS), leaf area (AF), specific leaf area (AFE), maximum assimilation (Amax), and maximum height (Hmax) at eight plots on the Eastern Cordillera of Colombia.
Discusión
El AF fue el rasgo que más coeficiente de variación presentó, lo que indica alta variación en los tipos de hojas en estos ecosistemas, aunque unos más abundantes que otros. En contraste, se observó una baja variación en la densidad de madera, influenciada por la alta agrupación de especies con maderas de densidades medias.
Tres especies de estos bosques presentaron hojas nanofilas, frecuentes en bosques templados (Webb, 1959). La categoría con más número de especies fue microfila, y a medida que aumentó el tamaño de la hoja, el número de especies en las categorías notofilas y mesofilas disminuyó, quedando sólo Oreopanax bogotensis en la categoría macrofila.
En los bosques tropicales de las tierras bajas de Ecuador, Grubb et al. (1963) reportaron las hojas macrofilas seguida de las mesofilas como las más abundantes. En bosques tropicales australianos Webb (1959) reportó la categoría mesofila como la más abundante, seguida de las notofilas. Vásquez-Valderrama & Solorza-Bejarano (2018), en su estudio de restauración ecológica, encontraron que en los bosques cercanos a Bogotá las especies presentaban hojas de las categorías nanofilas, microfilas y mesofilas descartando la presencia de hojas de mayor tamaño. En el presente estudio la categoría megafila, representada principalmente por palmas estuvo ausente.
La baja presencia de especies con hojas grandes podría ser un mecanismo de reducción de costos de construcción foliar (Williams et al., 1989; Sims & Pearcy, 1992), como estrategia para la inversión de recursos en otras partes de la planta, como tallos de mayor densidad y hojas más resistentes, longevas y con menos recambio (Lohbeck et al., 2015; Díaz et al., 2016). Sin embargo, también sería necesario determinar si la capacidad de absorción de la luz de toda una planta es menor cuando se produce hojas más pequeñas, ya que plantas con áreas foliares más pequeñas podrían estar produciendo más hojas. Las áreas foliares reducidas también podrían ser el reflejo de limitaciones en la disponibilidad de nutrientes en los suelos (Albert et al., 2010; Pierce et al., 2013).
Por un lado, los ecosistemas estudiados están en áreas con una larga historia de intervención humana, que fueron utilizadas para ganadería, cultivos y minería, y datos preliminares indican que sufrirían de fuertes déficits de algunos nutrientes (Posada & Norden, datos no publ.). Por otro lado, los suelos de montaña se caracterizan por tener bajas tasas de mineralización, ya que las bajas temperaturas reducen la actividad de los descomponedores (Pérez-Batallón et al., 1998).
Para Webb (1959) las formaciones de bosques lluviosos en el noroeste australiano presentan hojas pequeñas que se asocian a las propiedades del suelo, como la fertilidad, la humedad y el drenaje. Sin embargo, en suelos de baja fertilidad, como los mencionados por Fernández (2007), las especies de hojas grandes fueron abundantes. Por ello, existen varias posibles explicaciones sobre la mayor frecuencia de hojas de tamaño pequeño en estos bosques, pero los datos existentes no permiten determinar si son una consecuencia de limitaciones en la disponibilidad de nutrientes o una estrategia adaptativa a las condiciones propias de las altas montañas neotropicales.
Las hojas con alto AFE y bajo CFMS podrían ser mucho más vulnerables a los ataques por herbívoros por su alto contenido de agua o serían más propensas a sufrir daños mecánicos, porque invierten poca biomasa en su estructura foliar (Poorter, 2007; Quero et al., 2009). Al contrario, hojas con mayor CFMS, que se presume son más coriáceas y robustas, deberían ser más resistentes y duraderas ante disturbios abióticos y sufrir menos herbivoría (Wright et al., 2004; Fernández, 2007).
Wright et al. (2004) utilizaron mediciones de miles de especies a nivel mundial y mostraron que Amax se correlaciona con AFE. Este estudio confirma la validez de esta relación para especies de bosques altoandinos, ya que ambas variables estuvieron fuertemente relacionadas.Por ejemplo, las especies que presentaron los más altos valores de AFE también tuvieron altos valores de Amax, como Oreopanax bogotensis (AFE=287.5 cm2.g-1 y Amax=283.5 nm.g-1.s-1), Weinmannia tomentosa, (AFE= 266.8 cm2.g-1 y Amax=207.3 nm. g-1.s-1) , Baccharis macrantha (AFE= 139.9 cm2.g-1 y Amax= 146.6 nm.g-1.s-1) y Cordia cylindrostachya (AFE= 136.08 cm2.g-1 y Amax = 245 nm.g-1.s-1).
En cuanto al CFMS se observó de manera significativa que las especies que aumentaron su Amax, presentaron contenidos foliares de materia seca menores y viceversa, posiblemente porque las especies con CFMS bajo tienen proporcionalmente menos carbono invertido en estructuras defensivas e invierten una mayor parte en su maquinaria fotosintética (Zotz et al., 1995). Por lo tanto, nuestros datos sugieren que habría una fuerte “coordinación” entre rasgos morfológicos (AFE, CFMS) y rasgos fisiológicos (Amax).
Así, las hojas con bajo CFMS tendrían alto Amax, ya que la mayor parte de la biomasa se invertiría en estructuras relacionadas principalmente con la maquinaría fotosintética como los cloroplastos y estomas (De las Rivas, 2013); mientras que hojas con alto CFMS también invertirían en estructuras relacionadas con la defensa como el contenido de lignina, mayor fuerza tensíl foliar y grosor de hoja (Wright et al., 2004; Fernández, 2007) resultando en una “dilución” del Amax. (i.e., una hoja con mayor CFMS resulta en un denominador mayor en el Amax que una hoja con bajo CFMS).
En contraste con los rasgos foliares, no se encontró ningún patrón de coordinación funcional (De la Riva et al., 2014) entre los rasgos a nivel de hoja, con densidad de madera y altura máxima. Esto sugiere que estos rasgos actúan de manera independiente a los de las hojas, coincidiendo con Wright et al., (2007) y Baraloto et al., (2010), quienes argumentan que la densidad de la madera y la altura del individuo no están relacionadas en gran medida con el espectro de la economía de las hojas entre las especies leñosas de los bosques neotropicales. Similarmente, Reich et al., (2008) no encontraron relación entre los rasgos foliares y los de raíz en plantas de pastos, herbáceas y leñosas.
De la Riva et al. (2014), analizando 15 rasgos funcionales representativos de la estructura y fisiología de diferentes órganos de cinco especies del género Quercus, hallaron relaciones entre rasgos de hojas, tallo y raíz. Resaltaron las fuertes correlaciones entre los contenidos de materia seca de estas tres estructuras y que podrían ser representativos de la inversión que realiza la planta en sus tejidos y la longevidad de los mismos (Cornelissen et al., 1996; Wahl & Ryser 2000).
Sin embargo, estos estudios fueron hechos en un mismo género y nuestros datos sugieren que estas relaciones no se mantienen en comunidades con mayor diversidad de grupos taxonómicos.
Recientemente, Reich (2014), después de analizar múltiples investigaciones a nivel global, encontró que, en algunos casos, los rasgos relacionados con la economía de la hoja actuaban de manera independiente a los del tallo, pero otros resultados de su análisis contradecían estos hallazgos. De esta manera, plantea la hipótesis sobre si realmente hay coordinación o independencia de rasgos de la hoja con los del tallo y la raíz.
En el análisis de componentes principales las relaciones entre los rasgos funcionales se mantienen, lo que sugiere la presencia de plantas con estrategias conservativas y adquisitivas (Díaz et al., 2004; Wright et al., 2004; Villar et al., 2008; Domínguez et al., 2012) en el ecosistema evaluado.
Algunas especies, de las cuales cabe resaltar Cordia cylindrostachya, Macrocarpaea glabra, Piper bogotense y Ageratina tinifolia, mostraron estrategias de tipo “adquisitivo”, dado por sus altos valores de AFE y bajos CFMS. Estas especies dependerían de un buen acceso a recursos y tendrían un alto consumo de agua y nutrientes y se esperaría que fueran menos comunes en hábitats en ambientes carentes de estos recursos (Grime et al., 1997; Reich et al., 1999; Villar et al., 2008; Domínguez et al., 2012). Estas especies adquisitivas también se caracterizaron por presentar una Amax alta y una baja DM, precisamente porque su finalidad es optimizar la tasa fotosintética, disminuyendo los costos de producción de hojas, alcanzando altas tasas de crecimiento (Grime et al., 1997) y adquisición de recursos, siendo dominantes en suelos fértiles (Albert et al., 2010; Pierce et al., 2013)
En el otro extremo del gradiente de variación (Figura 3), se ubicaron las plantas que mostraron estrategia conservativa (Quero et al., 2009) es decir, bajas Amax, una menor AFE y una alta acumulación y retención de materia (CFMS), siendo a la vez las más abundantes. Este comportamiento se observó de manera notoria en la familia Ericaceae, que tenía un CFMS 43 % superior al promedio y un AFE inferior al promedio.
Para De la Riva et al. (2014) estos tipos de plantas hacen un uso más eficiente de los recursos en los diferentes tejidos, mejorando su protección, perdurabilidad y resistencia a diferentes tipos de estrés ambiental (Freschet et al., 2010). Tienen, además, mayor capacidad de supervivencia a la defoliación por herbívoros, ya que presentan hojas con tejidos densos y bajas tasas de crecimiento (Albert et al., 2010; Pierce et al., 2013), lo que las hace ser más competitivas en el tiempo en suelos pocos fértiles (Hobbie, 1992; Aerts,1995; Pierce et al., 2013).
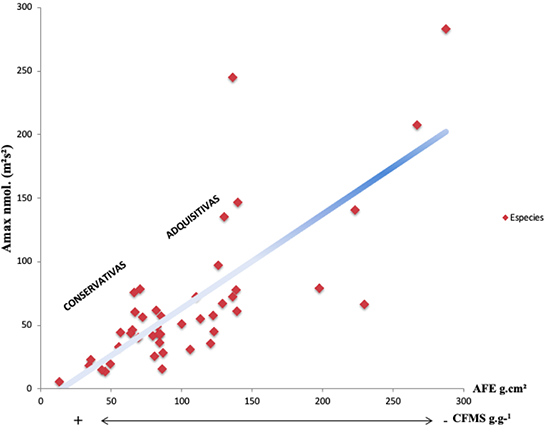
Figura 3. Gradiente de variación de las estrategias adquisitivas y conservativas en plantas de ocho parcelas en la Cordillera Oriental de Colombia, a partir de la tasa de asimilación máxima (Amax) contrastada con los valores de área foliar específica (AFE) y contenido foliar de materia seca (CFMS).
Figure 3. Variation gradient of the acquisitive and conservative strategies in plant species at eight plots in the Eastern Cordillera of Colombia, based on the maximum assimilation rate (Amax) contrasted with the values of specific leaf area (AFE) and leaf dry matter content (CFMS).
Este estudio representa una descripción inicial del espectro de variación de cuatro rasgos foliares y dos a nivel de tallo, así como las relaciones entre estos, en ecosistemas secundarios arbustivos altoandinos. Los resultados muestran que las hojas son pequeñas en la mayoría de especies, lo que podría sugerir que el tamaño de la hoja es un mecanismo de respuesta a la perturbación o a los factores abióticos (Lavorel & Garnier 2002; Cornelissen et al., 2003).Estos resultados se asemejan en algunos casos a los patrones de varios estudios desarrollados con estos rasgos (Grime et al., 1997; Wright et al., 2004; Fernández, 2007; Quero et al., 2009; Reich et al., 2008), lo que demuestra la existencia de plantas con arreglos funcionales similares, independiente de la ubicación de su hábitat.
Los resultados de este estudio confirmaron que hay una fuerte correlación entre rasgos funcionales foliares, pero también se observó una ausencia de coordinación entre rasgos foliares con los dos medidos a nivel del fuste; por lo que se hace necesario ampliar la muestra de los rasgos en futuras investigaciones, en especial de tallo, con lo que se podría ratificar el indicio de independencia del funcionamiento de estos órganos de la planta, como lo sugieren Laughlin et al. (2010) y Freschet et al. (2010).
La alta frecuencia de especies con rasgos conservativos sugiere que los bosques secundarios muestreados son generalmente pobres en recursos y sometidos a diferentes tipos de estrés ambiental, probablemente debido a siglos de intensa intervención humana, y en ellos se establecen mayoritariamente plantas pioneras, que se concentran en la retención de recursos (De la Riva et al., 2014). Por lo tanto, los mecanismos de restauración a largo plazo, deberían enfocarse en estas especies.
Referencias
Aerts, R. (1995). The advantages of being evergreen. Trends in Ecology & Evolution, 10 (10), 402-407.
https://doi.org/10.1016/S0169-5347(00)89156-9
Albert, C. H., Thuiller, W., Yoccoz, N. G., Douzet, R., Aubert, S. & Lavorel S. (2010). A multi- trait approach reveals the structure and the relative importance of intra- vs. interspecific variability in plant traits. Functional Ecology, 24 (6), 1192-1201.
https://doi.org/10.1111/j.1365-2435.2010.01727.x
Baraloto, C., Timothy Paine C. E., Poorter, L., Beauchene, J., Bonal, D., Domenach, A. M., Herault, B.,…..Chave, J. (2010). Decoupled leaf and stem economics in rain forest trees. Ecology Letters, 13(11), 1338-1347.
https://doi.org/10.1111/j.1461-0248.2010.01517.x
Chazdon, R. L. (1992). Photosynthetic plasticity of two rain forest shrubs across natural gap transects. Oecologia, 92(4), 586-595.
https://doi.og/10.1007/BF00317853
Chazdon, R. L. & Coe, F. G. (1999). Ethnobotany of woody species in second growth, old-growth, and selectively logged forest of Northeastern Costa Rica. Conservation Biology, 13(6), 1312-1322.
https://doi.org/10.1046/j.1523-1739.1999.98352.x
Chazdon, R. L. & Montgomery, R. A. (2002). La adquisición de carbono en las plantas. En M.R. Guariguata. & G. H. Kattan. (Ed.), Ecología y conservación de bosques neotropicales. (Pp. 225-250). Libro Universitario Regional.
Cornelissen J. H. C., Castro-Díez P. & Hunt, R. (1996). Seedling growth, allocation and leaf attributes in a wide range of woody plant species and types. Journal of Ecology, 84(5), 755-765.
https://doi.org/10.2307/2261337
Cornelissen, J. H. C., Lavorel, S., Garnier. E., Díaz, S., Buchmann. P., Gurvich, D. E., Reich, P. B.,….. Poorter, H. (2003). A handbook of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany, 51(4), 335-380.
https://doi.org/10.1071/BT02124
De la Riva, E. G., Pérez, R. I., Navarro, C. M., Olmo, M., Marañón, T. & Villar, R. (2014). Rasgos funcionales en el género Quercus: estrategias adquisitivas frente a conservativas en el uso de recursos. Ecosystems, 23(2), 82-89.
https://10.7818/ECOS.2014.23-2.11
Díaz, S., Hodgson, J. G., Thompson, K., Cabido. M., Cornelissen, J. H. C., Jalili, A, Montserrat-Marti G.,…Zak, M. R. (2004). The plant traits that drive ecosystems: Evidence from three continents. Journal of Vegetation Science, 15(3), 295-304.
https://doi.org/10.1111/j.1654-1103.2004.tb02266.x
Díaz, S., Kattge, J., Cornelissen, J., Wright, I., Lavorel, S., Dray, S., Reu, B.,…. Mahecha,. M. (2016). The global spectrum of plant form and function. Nature 529, 177-172.
https://doi.org/10.1038/nature16489
Domínguez, M. T., Aponte, C., Pérez-Ramos M. I., García, L. V., Villar, R. & Marañón, T. (2012). Relationships between leaf morphological traits, nutrient concentrations and isotopic signatures for Mediterranean woody plant species and communities. Plant Soil, 357, 407-424.
https://doi.org/10.1007/s11104-012-1214-7
FAO, Organización de las Naciones Unidas para la Alimentación y la Agricultura. (2012). El Estado de los Bosques del Mundo.
http://www.fao.org/docrep/013/i2000s/
Fearnside, P. M. & Guimaraes, W. M. (1996). Carbon uptake by secondary forest in Brazilian Amazonia. Forest Ecology and Management, 80(1-3), 35-46.
https://doi.org/10.1016/0378-1127(95)03648-2
Fernández, M. F. (2007). Functional diversity of tropical very humid forests in the northwest of Costa Rica according to leaf traits and wood basic density. (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza.
Freschet, G. T., Cornelissen, J. H. C., Van Logtestijn, R. S. P. & Aerts, R. (2010). Evidence of the “plant economics spectrum” in a subarctic flora. Journal of Ecology, 98(2), 362-373.
https://doi.org/10.1111/j.1365-2745.2009.01615.x
Grime. J. P., Thompson. K., Hunt, R., Hodgson, J. G., Cornelissen, J. H. C., Rorison, I. H., Hendry, G. A. F.,…..Whitehouse J. (1997). Integrated screening validates primary axes of specialisation in plants. Oikos, 79(2), 259-281.
https://doi.org/10.2307/3546011
Grubb. P. J., Lloyd, J. R., Pennington, T. D. & Whitmore T. C. (1963). A comparison of montane and lowland rain forest in Ecuador I. The forest structure, physiognomy, and floristic. Journal of Ecology, 51(3), 567-601.
https://doi.org/10.2307/2257748
Hobbie, S. E. (1992). Effects of plant species on nutrient cycling. Trends in Ecoloy and Evolution, 7(10), 336-339.
https://doi.org/10.1016/S0167-8809(99)00145-0
IDEAM. Instituto de Hidrología, Meteorología y Estudios Ambientales. (2008). Mapas de precipitación promedio en Colombia. Grupo de Climatología y Agro meteorología- Subdirección de Meteorología.
Kitajima, K. (1994). Relative importance of photosynthetic traits and allocation pattern as correlates of seedling shade tolerance of 13 tropical trees. Oecologia, 98, 419-428.
https://doi.org/10.1007/BF00324232
Laughlin, D. C., Leppert, J. J., Moore, M. M. & Sieg, C. H. (2010). A multi-trait test of the leaf-height-seed plant strategy scheme with 133 species from a pine forest flora. Functional Ecology, 24(3), 493-501.
https://doi.org/10.1111/j.1365-2435.2009.01672.x
Lavorel, S. & Garnier, E. (2002). Predicting changes in community composition and ecosystem functioning from plant traits: Revisiting the Holy Grail. Functional Ecology, 16(5), 545-556.
https://doi.org/10.1046/j.1365-2435.2002.00664.x
Lohbeck, M., Lebrija-Trejos, E., Martínez-Ramos, M., Meave, J. A., Poorter, L. & Bongers, F., (2015). Functional trait strategies of trees in dry and wet tropical forests are similar but differin their consequences for succession. Plos One, 10(4), e0123741.
https://doi.org/10.1371/journal.pone.0123741
Moles, A.T. & Westoby, M. (2006). Seed size and plant strategy across the whole life cycle. Oikos, 113(1), 91-105.
https://doi.org/10.1111/j.0030-1299.2006.14194.x
OIT. Organización Internacional de MaderasTtropicales. (2006). Status of Tropical Forest Management.
http://www.itto.int/en/sfm/
Pérez-Batallón, P., Ouro, G., Merino, A. & Macías, F. (1998). Descomposición de materia orgánica, biomasa microbiana y emisión de CO2 en un suelo forestal bajo diferentes manejos selvícolas. Edafología, (5), 83-93.
Pierce, S., Brusa, G., Vagge, I. & Cerabolini B. (2013). Allocating CSR plant functional types: the use of leaf economics and size traits to classify woody and herbaceous vascular plants. Functional. Ecology, 27(4), 1002-1010.
https://doi.org/10.1111/1365-2435.12095
Poorter, L. (2007). Are species adapted to their regeneration niche, adult niche, or both? The American Naturalist, 169(4), 33-42.
https://doi.org/10.1086/512045
Quero, J. L., Villar, R., Poorter, L., Marañón, T., Matías, L., Aponte. C., García, L.,….. Zamora, R. (2009). Espectro de variación foliar en bosques mediterráneos del sur de la Península Ibérica. En G. González (Presidencia), Conferencia llevada a cabo en el V Congreso Forestal Español. Ávila, España
Reich, P. B. (2014). The world-wide ‘fast-slow’ plant economics spectrum: a traits manifesto. Journal of Ecology, 102(2), 275-301.
https://doi.org/10.1111/1365-2745.12211
Reich, P. B., Ellsworth, D. S., Walters. M. B., Vose. J. M., Gresham, C., Volin, J. C. & Bowman, W. (1999). Generality of leaf trait relationships: a test across six biomes. Ecology, 80(6), 1955-1969.
https://doi.org/10.2307/176671
Reich, P. B., Tjoelker, M. G., Pregitzer, K. S., Wright, I. J., Oleksyn, J. & Machado, J. L. (2008). Scaling of respiration to nitrogen in leaves, stems and roots of higher land plants. Ecology Letters, 11(8),793-801.
https://doi.org/10.1111/j.1461-0248.2008.01185.x
Ruiz, R. J. & Villar. R. (2005). Relative growth rate and biomass allocation in ten woody species with different leaf longevity using phyllogenetic independent contrasts (PICs). Plant Biology, 7(5), 484-494.
https://10.1055/s-2005-865905
Sims, D. A. & Pearcy, R. W. (1992). Response of leaf anatomy and photosynthetic capacity in Alocasia macrorrizha (Araceae) to a transfer from low to high light. American Journal of Botany, 79(4), 449-455.
https://doi.org/10.1002/j.1537-2197.1992.tb14573.x
Vásquez, V. M. & Solorza, B. J. (2018). Agrupación funcional de especies vegetales para la restauración ecológica de ecosistemas de montaña, Bogotá, Colombia. Colombia Forestal, 21(1), 517.
https://doi.org/10.14483/2256201X.11730
Wadsworth, F.H. 1997. Forest production for Tropical America. Agricultural Handbook 710. Department of Agriculture.
Wahl, S. & Ryser, P. (2000). Root tissue structure is linked to ecological strategies of grasses. New Phytologist, 148(3), 459-471.
https://doi.org/10.1046/j.1469-8137.2000.00775.x
Webb, L. J. (1959). A physiognomic classification of Australian rain forests. Journal of Ecology, 47(55), 551-570.
https://doi.org/10.2307/2257290
Williams, K., Field, C. B. & Mooney, H. A. (1989). Relationship among leaf construction cost leaf longevity and light environment in rain-forest plants of the genus Piper. The American Naturalist, 133(2), 198-211.
https://doi.org/10.1086/284910
Wright. I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Zdravko, B., Frans. B., Bares, J. C.,….. Villar R. (2004). The worldwide leaf economics spectrum. Nature, 428, 821-827.
https://doi.org/10.1038/nature02403
Wright, I. J., Ackerly, D., Bongers, F., Harms, K., Manríquez. G., Ramos, M., Mazer, S.,…..Wright, J.(2007). Relationships among ecologically important dimensions of plant trait variation in seven neotropical forests. Annals of Botany, 99(1), 1003-1015.
https://doi.org/10.1093/aob/mcl066
Zotz, G., Harris, G., Koniger, M. & Winter, K. (1995). High rates of photosynthesis in the tropical pioneer tree, Ficus insípida Willd, Flora 190, 265-272.
https://doi.org/10.1016/S0367-2530(17)30663-1
1Universidad Distrital Francisco José de Caldas. Bogotá, Colombia
References
Aerts, R. (1995). The advantages of being evergreen. Trends in Ecology & Evolution, 10 (10), 402-407. https://doi.org/10.1016/S0169-5347(00)89156-9
Albert, C. H., Thuiller, W., Yoccoz, N. G., Douzet, R., Aubert, S. & Lavorel S. (2010). A multi- trait approach reveals the structure and the relative importance of intra- vs. interspecific variability in plant traits. Functional Ecology, 24 (6), 1192-1201. https://doi.org/10.1111/j.1365-2435.2010.01727.x
Aquino, S. (2009). Impactos humanos en la provisión de servicios ecosistémicos por bosques tropicales muy húmedos: un enfoque de ecología funcional (Tesis maestría). Centro Agronómico Tropical de Investigación y Enseñanza.
Baraloto, C., Timothy Paine C. E., Poorter, L., Beauchene, J., Bonal, D., Domenach, A. M., Herault, B.,…..Chave, J. (2010). Decoupled leaf and stem economics in rain forest trees. Ecology Letters, 13(11), 1338-1347. https://doi.org/10.1111/j.1461-0248.2010.01517.x
Chazdon, R. L. (1992). Photosynthetic plasticity of two rain forest shrubs across natural gap transects. Oecologia, 92(4), 586-595. https://doi.og/10.1007/BF00317853
Chazdon, R. L. & Coe, F. G. (1999). Ethnobotany of woody species in second growth, old-growth, and selectively logged forest of Northeastern Costa Rica. Conservation Biology, 13(6), 1312-1322. https://doi.org/10.1046/j.1523-1739.1999.98352.x
Chazdon, R. L. & Montgomery, R. A. (2002). La adquisición de carbono en las plantas. En M.R. Guariguata. & G. H. Kattan. (Ed.), Ecología y conservación de bosques neotropicales. (Pp. 225-250). Libro Universitario Regional.
Cornelissen J. H. C., Castro-Díez P. & Hunt, R. (1996). Seedling growth, allocation and leaf attributes in a wide range of woody plant species and types. Journal of Ecology, 84(5), 755-765. https://doi.org/10.2307/2261337
Cornelissen, J. H. C., Lavorel, S., Garnier. E., Díaz, S., Buchmann. P., Gurvich, D. E., Reich, P. B.,….. Poorter, H. (2003). A handbook of protocols for standardised and easy measurement of plant functional traits worldwide. Australian Journal of Botany, 51(4), 335-380. https://doi.org/10.1071/BT02124
De la Riva, E. G., Pérez, R. I., Navarro, C. M., Olmo, M., Marañón, T. & Villar, R. (2014). Rasgos funcionales en el género Quercus: estrategias adquisitivas frente a conservativas en el uso de recursos. Ecosystems, 23(2), 82-89. https://10.7818/ECOS.2014.23-2.11
De Las Rivas, J. (2013). La luz y el aparato fotosintético. En J. A. Bieto., M. Talón. (Ed.), Fundamentos de fisiología vegetal. (Pp.165-168). Ediciones de la Universidad de Barcelona.
Díaz, S., Hodgson, J. G., Thompson, K., Cabido. M., Cornelissen, J. H. C., Jalili, A, Montserrat-Marti G.,…Zak, M. R. (2004). The plant traits that drive ecosystems: Evidence from three continents. Journal of Vegetation Science, 15(3), 295-304. https://doi.org/10.1111/j.1654-1103.2004.tb02266.x
Díaz, S., Kattge, J., Cornelissen, J., Wright, I., Lavorel, S., Dray, S., Reu, B.,…. Mahecha,. M. (2016). The global spectrum of plant form and function. Nature 529, 177-172. https://doi.org/10.1038/nature16489
Domínguez, M. T., Aponte, C., Pérez-Ramos M. I., García, L. V., Villar, R. & Marañón, T. (2012). Relationships between leaf morphological traits, nutrient concentrations and isotopic signatures for Mediterranean woody plant species and communities. Plant Soil, 357, 407-424. https://doi.org/10.1007/s11104-012-1214-7
FAO, Organización de las Naciones Unidas para la Alimentación y la Agricultura. (2012). El Estado de los Bosques del Mundo. http://www.fao.org/docrep/013/i2000s/
Fearnside, P. M. & Guimaraes, W. M. (1996). Carbon uptake by secondary forest in Brazilian Amazonia. Forest Ecology and Management, 80(1-3), 35-46. https://doi.org/10.1016/0378-1127(95)03648-2
Fernández, M. F. (2007). Functional diversity of tropical very humid forests in the northwest of Costa Rica according to leaf traits and wood basic density. (Tesis de maestría). Centro Agronómico Tropical de Investigación y Enseñanza.
Freschet, G. T., Cornelissen, J. H. C., Van Logtestijn, R. S. P. & Aerts, R. (2010). Evidence of the “plant economics spectrum” in a subarctic flora. Journal of Ecology, 98(2), 362-373. https://doi.org/10.1111/j.1365-2745.2009.01615.x
Grime. J. P., Thompson. K., Hunt, R., Hodgson, J. G., Cornelissen, J. H. C., Rorison, I. H., Hendry, G. A. F.,…..Whitehouse J. (1997). Integrated screening validates primary axes of specialisation in plants. Oikos, 79(2), 259-281. https://doi.org/10.2307/3546011
Grubb. P. J., Lloyd, J. R., Pennington, T. D. & Whitmore T. C. (1963). A comparison of montane and lowland rain forest in Ecuador I. The forest structure, physiognomy, and floristic. Journal of Ecology, 51(3), 567-601. https://doi.org/10.2307/2257748
Hobbie, S. E. (1992). Effects of plant species on nutrient cycling. Trends in Ecoloy and Evolution, 7(10), 336-339. https://doi.org/10.1016/S0167-8809(99)00145-0
IDEAM. Instituto de Hidrología, Meteorología y Estudios Ambientales. (2008). Mapas de precipitación promedio en Colombia. Grupo de Climatología y Agro meteorología- Subdirección de Meteorología.
Kitajima, K. (1994). Relative importance of photosynthetic traits and allocation pattern as correlates of seedling shade tolerance of 13 tropical trees. Oecologia, 98, 419-428. https://doi.org/10.1007/BF00324232
Laughlin, D. C., Leppert, J. J., Moore, M. M. & Sieg, C. H. (2010). A multi-trait test of the leaf-height-seed plant strategy scheme with 133 species from a pine forest flora. Functional Ecology, 24(3), 493-501. https://doi.org/10.1111/j.1365-2435.2009.01672.x
Lavorel, S. & Garnier, E. (2002). Predicting changes in community composition and ecosystem functioning from plant traits: Revisiting the Holy Grail. Functional Ecology, 16(5), 545-556. https://doi.org/10.1046/j.1365-2435.2002.00664.x
Lohbeck, M., Lebrija-Trejos, E., Martínez-Ramos, M., Meave, J. A., Poorter, L. & Bongers, F., (2015). Functional trait strategies of trees in dry and wet tropical forests are similar but differin their consequences for succession. Plos One, 10(4), e0123741. https://doi.org/10.1371/journal.pone.0123741
Mahecha, G. E., Ovalle, E. A., Salamanca, D. C, Fernández, R. A. & Barrero, B. D. (2012). Vegetación el Territorio CAR. 450 especies de sus Llanuras y Montañas. Imprenta Nacional de Colombia.
Moles, A.T. & Westoby, M. (2006). Seed size and plant strategy across the whole life cycle. Oikos, 113(1), 91-105. https://doi.org/10.1111/j.0030-1299.2006.14194.x
OIT. Organización Internacional de MaderasTtropicales. (2006). Status of Tropical Forest Management. http://www.itto.int/en/sfm/
Pérez-Batallón, P., Ouro, G., Merino, A. & Macías, F. (1998). Descomposición de materia orgánica, biomasa microbiana y emisión de CO2 en un suelo forestal bajo diferentes manejos selvícolas. Edafología, (5), 83-93.
Pierce, S., Brusa, G., Vagge, I. & Cerabolini B. (2013). Allocating CSR plant functional types: the use of leaf economics and size traits to classify woody and herbaceous vascular plants. Functional. Ecology, 27(4), 1002-1010. https://doi.org/10.1111/1365-2435.12095
Poorter, L. (2007). Are species adapted to their regeneration niche, adult niche, or both? The American Naturalist, 169(4), 33-42. https://doi.org/10.1086/512045
Quero, J. L., Villar, R., Poorter, L., Marañón, T., Matías, L., Aponte. C., García, L.,….. Zamora, R. (2009). Espectro de variación foliar en bosques mediterráneos del sur de la Península Ibérica. En G. González (Presidencia), Conferencia llevada a cabo en el V Congreso Forestal Español.
Reich, P. B. (2014). The world-wide ‘fast-slow’ plant economics spectrum: a traits manifesto. Journal of Ecology, 102(2), 275-301. https://doi.org/10.1111/1365-2745.12211
Reich, P. B., Ellsworth, D. S., Walters. M. B., Vose. J. M., Gresham, C., Volin, J. C. & Bowman, W. (1999). Generality of leaf trait relationships: a test across six biomes. Ecology, 80(6), 1955-1969. https://doi.org/10.2307/176671
Reich, P. B., Tjoelker, M. G., Pregitzer, K. S., Wright, I. J., Oleksyn, J. & Machado, J. L. (2008). Scaling of respiration to nitrogen in leaves, stems and roots of higher land plants. Ecology Letters, 11(8), 793-801. https://doi.org/10.1111/j.1461-0248.2008.01185.x
Ruiz, R. J. & Villar. R. (2005). Relative growth rate and biomass allocation in ten woody species with different leaf longevity using phyllogenetic independent contrasts (PICs). Plant Biology, 7(5), 484-494. https://10.1055/s-2005-865905
Sims, D. A. & Pearcy, R. W. (1992). Response of leaf anatomy and photosynthetic capacity in Alocasia macrorrizha (Araceae) to a transfer from low to high light. American Journal of Botany, 79(4), 449-455. https://doi.org/10.1002/j.1537-2197.1992.tb14573.x
Vásquez, V. M. & Solorza, B. J. (2018). Agrupación funcional de especies vegetales para la restauración ecológica de ecosistemas de montaña, Bogotá, Colombia. Colombia Forestal, 21(1), 517. https://doi.org/10.14483/2256201X.11730
Villar, R. J., Ruiz-Robleto, J. L., Quero, J. L., Poorter, H., Valladares. F. & Marañón T. (2008). Tasas de crecimiento en especies leñosas, aspectos funcionales e implicaciones ecológicas. En F. Valladares, F. (Ed.). (2008). Ecología del bosque mediterráneo en un mundo cambiante. Organismo Autónomo de Parques Nacionales.
Wadsworth, F.H. 1997. Forest production for Tropical America. Agricultural Handbook 710. Department of Agriculture.
Wahl, S. & Ryser, P. (2000). Root tissue structure is linked to ecological strategies of grasses. New Phytologist, 148(3), 459-471. https://doi.org/10.1046/j.1469-8137.2000.00775.x
Webb, L. J. (1959). A physiognomic classification of Australian rain forests. Journal of Ecology, 47(55), 551-570. https://doi.org/10.2307/2257290
Williams, K., Field, C. B. & Mooney, H. A. (1989). Relationship among leaf construction cost leaf longevity and light environment in rain-forest plants of the genus Piper. The American Naturalist, 133(2), 198-211. https://doi.org/10.1086/284910
Wright. I. J., Reich, P. B., Westoby, M., Ackerly, D. D., Zdravko, B., Frans. B., Bares, J. C.,….. Villar R. (2004). The worldwide leaf economics spectrum. Nature, 428, 821-827. https://doi.org/10.1038/nature02403
Wright, I. J., Ackerly, D., Bongers, F., Harms, K., Manríquez. G., Ramos, M., Mazer, S.,…..Wright, J.(2007). Relationships among ecologically important dimensions of plant trait variation in seven neotropical forests. Annals of Botany, 99(1), 1003-1015. https://doi.org/10.1093/aob/mcl066
Zotz, G., Harris, G., Koniger, M. & Winter, K. (1995). High rates of photosynthesis in the tropical pioneer tree, Ficus insípida Willd, Flora 190, 265-272. https://doi.org/10.1016/S0367-2530(17)30663-1
How to Cite

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Copyright (c) 2022 Instituto de Investigación de Recursos Biológicos Alexander Von Humboldt