Abstract (en):
Abstract (es):
La mayor parte de los estudios realizados hasta el momento sobre el complejo de páramos de Chingaza se han desarrollado principalmente en las zonas cercanas a Bogotá y algunos sectores del Parque Nacional Natural Chingaza. El objetivo del presente estudio fue caracterizar la zona de transición bosque-páramo en el complejo. Realizamos 5 transectos altitudinales en áreas con buen estado de conservación, en los que se obtuvieron 11,588 registros de ocurrencias y 1382 registros de rasgos funcionales de vegetación, edafofauna, anfibios y aves. Registramos dos especies de plantas en estado vulnerable (VU) (Hedyosmum parvifolium y Centronia brachycera) y un nuevo taxón endémico para este complejo de páramo (Puya loca). Análisis preliminares de los datos presentados sugieren variación en estructura biótica a lo largo del gradiente, y cambios en la composición de las comunidades. Con la información presentada se logró identificar la zona de transición entre el bosque altoandino y el páramo por medio de diversos atributos fisonómicos, florísticos, ecológicos y corológicos.
Keywords:
Ecotone, Elevation gradient, Functional traits, High mountain, Northern Andes (en)
Caracterización biológica en la zona de transición bosque-páramo del Complejo de Páramos Chingaza, Colombia
Biotic characterization of the forest-paramo transition zone in Chingaza Páramo Complex, Colombia
Recepción: 27 Diciembre 2017
Aprobación: 19 Marzo 2019
Resumen
La mayor parte de los estudios realizados hasta el momento sobre el complejo de páramos de Chingaza se han desarrollado principalmente en las zonas cercanas a Bogotá y algunos sectores del Parque Nacional Natural Chingaza. El objetivo del presente estudio fue caracterizar la zona de transición bosque-páramo en el complejo. Realizamos 5 transectos altitudinales en áreas con buen estado de conservación, en los que se obtuvieron 11 588 registros de ocurrencias y 1382 registros de rasgos funcionales de vegetación, edafofauna, anfibios y aves. Registramos dos especies de plantas en estado vulnerable (VU) (Hedyosmum parvifolium y Centronia brachycera) y un nuevo taxón endémico para este complejo de páramo (Puya loca). Análisis preliminares de los datos presentados sugieren variación en estructura biótica a lo largo del gradiente, y cambios en la composición de las comunidades. Con la información presentada se logró identificar la zona de transición entre el bosque altoandino y el páramo por medio de diversos atributos fisonómicos, florísticos, ecológicos y corológicos.
Palabras clave: Alta montaña, Ecotono, Gradiente altitudinal, Norte de los Andes, Rasgo funcional.
Abstract
The Chingaza paramo complex is located in the Colombian eastern Cordillera, in the departments of Cundinamarca, Boyacá and Meta. Most of our current knowledge about this complex comes from studies conducted near Bogotá and some focal sectors in the National Natural Park Chingaza. The goal of this study was to characterize the treeline transition zone through five elevational transects. As a result, we report 11 588 occurrences and 1382 data of functional traits for plants, edaphic fauna, amphibians, reptiles, and birds. In addition, we report occurrences from two vulnerable (VU) plant species (Hedyosmum parvifolium and Centronia brachycera) and a new endemic species (Puya loca). Preliminary analyses show natural variation in the landscape, community composition and altitudinal location of transition zones along the gradient and between locations. Using this dataset, it is possible to recognize defined transitions between high Andean forests and paramo ecosystems, and their elevation turnover through their physiognomic, floristic, ecological and chorological attributes.
Keywords: Ecotone, Elevation gradient, Functional traits, High mountain, Northern Andes.
Introducción
El complejo de páramos de Chingaza se encuentra sobre la cordillera Oriental de Colombia en los departamentos de Cundinamarca, Meta y Boyacá, con una extensión total de 111,667 ha. De acuerdo con el Instituto Humboldt (2017), el límite altitudinal inferior de la zona de transición se distribuye entre 2700 y 3200 m s. n. m., alcanzando la máxima elevación a 3980 m. Este complejo paramuno provee de agua a cerca del 80 % de la población de la ciudad de Bogotá, así como a la población de otros municipios de la sabana (Instituto Humboldt, 2017). El 67 % del complejo se encuentra bajo jurisdicción de figuras del Sistema Nacional de Áreas Protegidas (SINAP), y de este porcentaje, el 44 % corresponde al Parque Nacional Natural Chingaza. Por otra parte, hacia la zona norte existen amplias extensiones de páramo no incluidas en el parque en alto grado de vulnerabilidad por el aumento en las actividades agropecuarias.
La mayoría de los estudios realizados hasta el momento sobre el complejo de páramos de Chingaza se han desarrollado principalmente en las zonas cercanas a Bogotá, y en especial en sectores contiguos de la capital con el Parque Nacional Natural Chingaza (Lora, 1999; Vargas Ríos & Pedraza, 2003). Por lo anterior permanecen desconocidas las zonas en el noroccidente y oriente del complejo (i. e. Farallones de Medina, San Juanito). En el último caso, esto se debe principalmente a su difícil acceso y condiciones de orden público.
La flora de Chingaza ha sido trabajada en varias ocasiones de manera independiente, tanto por autoridades gubernamentales con fines de ordenamiento ambiental, como por investigadores. Fruto de los inventarios se han registrado 1229 especies de plantas pertenecientes a 521 géneros y 204 familias (Franco et al., 1986; Mahecha, 1989; Bernal & Jiménez, 1991; Jiménez & Bernal, 1991; Rosas, 1993; Pavajau, 1993; Rangel-Ch., 2000; Vargas Ríos & Pedraza, 2003; Madriñán, 2012) que equivalen al 23 % del total de plantas vasculares registradas en la región paramuna (Instituto Humboldt, 2017) siendo en su mayoría angiospermas. La distribución taxonómica de las especies está concentrada en una docena de géneros dominantes de manera similar a otros sistemas de montaña andinos (Simpson & Todzia, 1990; Cuesta et al., 2017). Las plantas con flor son el grupo taxonómico con mayor esfuerzo de muestreo y han sido el principal grupo de estudio en Chingaza. Las familias más abundantes, que por lo tanto son características de estos sistemas de alta montaña son: Asteraceae, Orchidaceae, Poaceae, Melastomataceae y Ericaceae (Ramírez et al., 2009; Cuesta et al., 2017) y los géneros más abundantes son Epidendrum, Pentacalia, Hypericum, Miconia y Pleurothallis (Rangel-Ch., 2000; Vargas Ríos & Pedraza, 2003). Este complejo contiene varias especies con distribución restringida o endémicas, entre ellas: Espeletia uribei, Passiflora cuatrecasasii, Pentacalia axillariflora y Tillandsia pallescens.
Por su parte, las comunidades de artrópodos son unidades fundamentales en los ecosistemas altoandinos, debido a que, como en otros ecosistemas, participan en el mantenimiento de la estructura del suelo, en la descomposición del material orgánico, en el ciclo de los nutrientes y en el mantenimiento de redes tróficas (Morales-Castaño & Amat-García, 2012). Adicionalmente, al ser empleados como organismos modelo, facilitan el seguimiento a procesos de regeneración en áreas con algún grado de intervención antropogénica (Díaz et al., 2007), ya que pueden reflejar el estado de salud y la evolución de la recuperación en bosques y páramos, los cuales son muy sensibles a estas alteraciones (Morales-Castaño & Amat-García, 2012). Los ecosistemas de alta montaña en el trópico se caracterizan por tener una alta diversidad de especies de artrópodos, debido a la heterogeneidad espacial, la cual es determinada por la topografía y principalmente por la arquitectura de las plantas y los diferentes tipos de vegetación (Amat & Vargas, 1991; Morales-Castaño & Amat-García, 2012). Lo anterior se debe a la estrecha correlación entre la diversidad de una comunidad de plantas y la comunidad de artrópodos, de modo que, a mayor número de especies vegetales, existirá una mayor oferta de recursos y hábitats para los artrópodos (Siemann et al., 1999). Así, los cambios en las comunidades de macroinvertebrados edáficos pueden ser explicados, en parte, por las variaciones en las comunidades vegetales, tanto en un gradiente temporal como en una variación de elevación (Siemann et al., 1999). En el Parque Nacional Natural Chingaza los insectos son el grupo más diverso entre los artrópodos, representado por 19 órdenes, 72 familias y 68 géneros, de los cuales se destacan los órdenes Coleoptera y Diptera con 17 y 15 familias, respectivamente. A pesar de esto, el orden de las mariposas (Lepidoptera) es el mejor estudiado taxonómicamente con un total de 3 familias, 4 géneros y 54 especies (Vargas Ríos & Pedraza, 2003).
En general, la riqueza de la herpetofauna disminuye a lo largo del gradiente dados los cambios ambientales desde condiciones climáticas y físicas moderadas hasta ambientes con condiciones extremas (Navas, 1999). Esta disminución es común en los anfibios y reptiles que habitan los gradientes altitudinales de los Andes (Lynch & Duellman, 1980; Navas, 1999, 2003; Vaira, 2001), lo que justifica el bajo número de especies de herpetos en bosques altoandinos al ser comparados con otros grupos vertebrados. Las altas elevaciones, bajas temperaturas y la presencia de un clima fluctuante representan un reto fisiológico para la vida anfibia (Navas, 1999). Los anfibios exhiben una representación minoritaria en estos hábitats, comparado con otros ecosistemas tropicales, siendo los géneros más representativos de la alta montaña colombiana Pristimantis y Atelopus, (Lynch & Suárez-Mayorga, 2002; Suárez-Mayorga, 1999; Lynch & Duellman, 1997; Lynch & Duellman, 1980). Se considera que este último género está gravemente amenazado, con muchas especies consideradas extintas en la actualidad (Rodríguez-Mahecha, 2005). En reptiles, los géneros más representativos de los páramos colombianos son Anolis y Stenocercus.
Se han realizado numerosas investigaciones sobre la diversidad de anfibios en el complejo Chingaza que datan de las décadas de los ochentas y noventas, en las cuales se describieron un gran número de las especies, en su mayoría de distribución restringida (Lynch & Suárez-Mayorga, 2002). En el complejo se encuentra el 19 % de las especies de anfibios de alta montaña y páramo registradas por varios autores para Colombia (Instituto Humboldt, 2017). El compendio de registros sobre la diversidad de anfibios presentes en el complejo de páramos de Chingaza muestra un total de 13 especies, con registros confirmados o basados en ejemplares depositados en colecciones biológicas. De estas, nueve especies son endémicas para la cordillera Oriental colombiana y cinco para Colombia (Hoyos, 1991; Osorno & Ardila, 2004; Suárez-Mayorga & Lynch, 2008; Medina-Rangel & López-Perilla, 2014; Acosta-Galvis, 2017). Descripciones de especies nuevas presentes en el complejo incluyen a Hyloxalus edwardsi de la familia Dendrobatidae (Lynch, 1982). La descripción del sapito arlequín Atelopus muisca (Bufonidae) (Rueda-Almonacid & Hoyos, 1991) endémica del Parque Nacional Natural Chingaza. La ranita de desarrollo directo, Pristimantis nervicus, fue descrita a partir de material coleccionado del Alto del Tigre ubicado al oriente del complejo (Lynch, 1994), con descripciones posteriores sobre sus aspectos reproductivos (Mendoza-Roldán, 2016). En 2001 Osorno-Muñoz et al. describieron Atelopus mandingues y Atelopus lozanoi (Bufonidae), sapitos arlequines endémicos. La primera es una especie relacionada con bosques en el municipio de Junín y la segunda es endémica de algunos páramos del municipio de La Calera. Recientemente, se han realizado aportes al conocimiento de la anurofauna del complejo Páramo de Chingaza, con la descripción de una nueva especie, Pristimantis dorado (Rivera-Correa et al., 2016). Esta descripción se realizó a partir de material coleccionado dentro del complejo a 2650 m s. n. m. en la localidad de San Juanito, departamento del Meta. Adicionalmente se confirmó la presencia de la especie (Pristimantis carranguerorum) para los bosques andinos del departamento de Cundinamarca (Anganoy-Criollo & Ramírez, 2017).
En cuanto a la avifauna, las cifras descritas por Linares-Romero et al. (2017) corresponden al reciente inventario de aves para el PNN Chingaza, donde reportan alrededor de 400 especies. Para el gradiente altitudinal que realizamos en este estudio (2400 - 3500 m s .n. m.) se cuenta con la presencia de 190 especies, correspondientes a 143 géneros y 39 familias. De estas últimas, las que presentan un mayor número de representantes en el complejo son Trochilidae, Thraupidae y Tyrannidae. También se han reportado siete especies endémicas y siete en alguna categoría de amenaza, de estas últimas tres de ellas endémicas de la cordillera Oriental (Vargas Ríos & Pedraza, 2003).
En el presente documento se exponen los resultados de muestreos realizados en cinco transectos altitudinales sobre la zona de transición del bosque al páramo, en áreas poco estudiadas y no protegidas por el PNN en el noroccidente del complejo Chingaza (Figura 1). Las estaciones a menor elevación se ubicaron en bosque altoandino continuando con la vegetación de páramo bajo (llamado comúnmente arbustal). La estación de mayor elevación se ubicó en las cimas de las montañas en el páramo medio o herbazal-pajonal (comúnmente páramo de frailejones). Siempre que fue posible se evitaron pendientes pronunciadas o cañadas. De igual manera se excluyen zonas con señales de intervención humana reciente, como carreteras, cultivos abandonados o zonas de extracción.
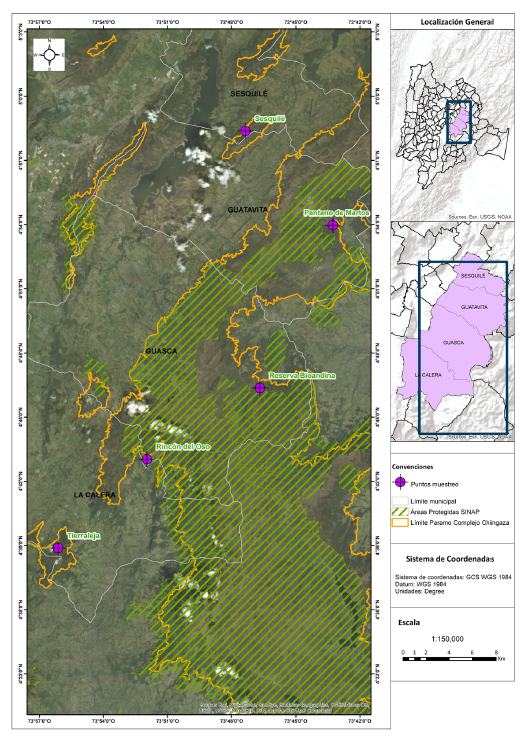
Figura 1.
Vista general del complejo de páramo Chingaza, cordillera Oriental de Colombia y ubicación de las estaciones de muestreo.
Fuente: elaboración propia.
El objetivo principal del presente trabajo fue identificar la asociación de los grupos biológicos en mención (vegetación, edafofauna, anfibios y aves) con respecto al gradiente altitudinal (tipos de vegetación) con relación a la identificación de la franja de transición bosque-páramo en el Complejo de Páramos de Chingaza.
Datos del proyecto
Título. Estudios bióticos (Plantas, Fauna Edáfica, Anfibios-reptiles y Aves) en el Complejo de Páramos Chingaza
Investigador principal. Santiago Madriñán
Fuentes de financiación. Convenio No. 14-13-014-171CE entre Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Universidad de Los Andes.
Descripción del área estudio. Se realizaron levantamientos biológicos, registro fotográfico y colección de especímenes en la zona occidental del complejo de páramos de Chingaza; correspondiente a los municipios de Sesquilé, Guatavita, La Calera y Guasca en el departamento de Cundinamarca. Las actividades realizadas se presentaron en un rango altitudinal entre los 2840 y 3580 m s. n. m.
Descripción del proyecto. Generar insumos técnicos y recomendaciones para la identificación de la franja de transición páramo-bosque en el Complejo de Páramos de Chingaza a partir de la caracterización de vegetación, edafofauna, anfibios y aves.
Cobertura taxonómica
Descripción. Se obtuvo un total de 11 588 registros: 9290 de ellos en vegetación correspondientes a 187 morfoespecies, 1458 en aves de 106 especies, 621 en edafofauna distribuidos en 63 morfoespecies y 219 registros de fauna herpetológica para 4 especies de reptiles y 9 especies de anfibios.
Se documentaron un total de 1382 registros de rasgos funcionales: 967 en vegetación correspondientes a 85 morfoespecies (5 especies más abundantes/dominantes de los levantamientos), 226 en aves en 52 especies. En cuanto a herpetofauna, se realizó la toma de datos solo sobre los rasgos funcionales de las especies de anfibios, siguiendo la metodología propuesta por Marín et al. (2016), para lo cual se levantaron 189 registros para 9 especies de anfibios en 2 órdenes (Anura, Caudata).
Categorías
Clase. Liliopsida.
Familia. Arecaceae, Asphodelaceae (como Xanthorrhoeaceae), Bromeliaceae, Cyperaceae, Dioscoreaceae, Eriocaulaceae, Iridaceae, Juncaceae, Liliaceae, Orchidaceae, Poaceae, Smilacaceae, Xyridaceae.
Clase. Magnoliopsida.
Adoxaceae, Alstroemeriaceae, Apiaceae, Apocynaceae, Aquifoliaceae, Araliaceae, Asteraceae, Brunelliaceae, Calceolariaceae, Campanulaceae, Caprifoliaceae, Caryophyllaceae, Chloranthaceae, Clethraceae, Clusiaceae, Cunoniaceae, Elaeocarpaceae, Fabaceae, Gentianaceae, Geraniaceae, Grossulariaceae, Hypericaceae, Lauraceae, Loranthaceae, Melastomataceae, Myricaceae, Myrtaceae, Orobanchaceae, Primulaceae (como Myrsinaceae), Polygalaceae, Polygonaceae, Primulaceae, Rosaceae, Rubiaceae, Scrophulariaceae, Solanaceae, Symplocaceae, Theaceae, Verbenaceae, Winteraceae.
Clase. Polypodiopsida.
Familia. Cyatheaceae, Blechnaceae, Dryopteridaceae, Polypodiaceae.
Clase. Arachnida.
Familia. Agelenidae, Anyphaenidae, Barychelidae, Caponiidae, Clubionidae, Corinnidae, Ctenidae, Dipluridae, Idiopidae, Linyphiidae, Lycosidae, Mimetidae, Oonopidae, Pholcidae, Prodidomidae, Salticidae, Theraphosidae, Theridiidae, Thomisidae, Zodariidae.
Clase. Insecta.
Familia. Bruchidae, Cantharidae, Carabidae, Ceratocanthidae, Chrysomelidae, Coccinellidae, Curculionidae, Elateridae, Formicidae, Hydrophilidae, Lampyridae, Leiodidae, Lycidae, Melolonthidae, Melyridae, Nitidulidae, Passalidae, Phengodidae, Pselaphidae, Scarabaeidae, Scolytidae, Scydmaenidae, Staphylinidae.
Clase. Amphibia.
Familia. Craugastoridae, Hylidae, Plethodontidae.
Clase. Reptilia.
Familia. Dactyloidae, Tropiduridae, Gymnophthalmidae.
Clase. Aves.
Familia. Accipitridae, Anatidae, Apodidae, Cathartidae, Cinclidae, Columbidae, Corvidae, Cotingidae, Cracidae, Emberizidae, Fringillidae, Furnariidae, Grallariidae, Icteridae, Parulidae, Picidae, Psittacidae, Rallidae, Ramphastidae, Rhinocryptidae, Scolopacidae, Strigidae, Thraupidae, Trochilidae, Troglodytidae, Trogonidae, Turdidae, Tyrannidae.
Cobertura geográfica
Descripción. Colombia: departamento de Cundinamarca, municipios de Sesquilé, Guatavita, La Calera y Guasca.
Coordenadas. 4°38’13.2’’N y 4°58’30’’N Latitud; 74°17’13.2’’O y 73°43’15.6’’O Longitud
Cobertura temporal
9 de octubre de 2014 - 16 de abril de 2015
Datos de las colecciones
Nombres de las colecciones. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAvH), Museo de Historia Natural - Universidad de los Andes (ANDES).
Identificadores de las colecciones. Registro Nacional de Colecciones: 3 y 158.
Identificador de la colección parental. No aplica.
Método de preservación de los especímenes. Secado y prensado. Alcohol. Montado con alfileres. Disecado.
Materiales y métodos
Área de estudio. Las localidades de levantamiento de información se ubican en la zona occidental del complejo de páramos de Chingaza; correspondiente a los municipios de Sesquilé, Guatavita, La Calera y Guasca en el departamento de Cundinamarca. El rango de elevación caracterizado varió entre los 2840 y 3580 m s. n. m.
Las localidades de trabajo se relacionan a continuación:
-
Municipio Sesquilé, Vereda Chaleche, Finca Rodamonte, 04º58’20,8”N 073º47’13,9”O
Municipio Guatavita, Vereda Monquentiva, Pantano de Martos, 04º54’30,9”N 073º43’49,6”O
Municipio Guasca, Vereda Rincón del Oso, Finca Suasié, 04º43’15,2”N 073º51’50,6”O
Municipio La Calera, Vereda Jerusalén, Finca Tierraleja, 04º38’43,82”N 073º56’2,56”O
Municipio Guasca, Reserva Bioandina, 04º46’4,3”N 073º46’38,7”O
Descripción del muestreo. Se realizaron cinco transectos altitudinales en zonas con buen estado de conservación y fuera del polígono del Parque Nacional Natural Chingaza con el fin de generar insumos técnicos para determinar la zona de transición bosque-páramo. Se establecieron transectos altitudinales partiendo del bosque altoandino, seguido del arbustal o páramo bajo y finalmente el páramo medio entendido como pajonal-herbazal. En cada transecto se ubicaron estaciones de muestreo aproximadamente cada 100 m de elevación, en las cuales se implementaron parcelas y puntos de muestreo siguiendo la metodología propuesta por Marín et al. (2016). La evaluación de los grupos taxonómicos se realizó en una ocasión por localidad y durante un máximo de 12 días en zonas con baja intervención humana evidente. Las actividades realizadas se presentaron en rangos altitudinales entre los 2840-3580 m s. n. m. En cada transecto se evaluó la vegetación, edafofauna, fauna herpetológica y aves. Los muestreos para cada uno de los anteriores componentes se realizaron en las mismas elevaciones de cada estación, siguiendo los protocolos suministrados por el Instituto Alexander von Humboldt (Marín et al., 2016; Laboratorio de Genética de la Conservación, 2014).
Descripción de la metodología paso a paso. Previo al trabajo en campo se realizó la búsqueda de lugares potenciales, consultando la cartografía disponible (Sarmiento et al., 2013). Los sitios seleccionados fueron visitados verificando las condiciones de acceso junto con las condiciones de conservación del gradiente altitudinal. En la mayoría de los casos personal del Instituto Humboldt acompañó esta actividad y/o fue consultado y obtenido el visto bueno para el inicio de las actividades formales de campo.
En las localidades seleccionadas se establecieron transectos altitudinales con estaciones ubicadas a una distancia entre 70 y 110 m. En el caso de las plantas se establecieron tres parcelas de 25 m x 4 m en el bosque y 12.5 m x 4 m, tanto para el arbustal como para el páramo medio. En cada una de estas parcelas se contabilizó el número de individuos por especie, se tomaron medidas de altura, diámetros de copa y CAP. En el caso de individuos clonales y/o herbáceos, se estimó visualmente la cobertura en porcentaje con respecto al área de la subparcela. Para los rasgos funcionales de cada una de las parcelas se seleccionó una subparcela de la cual se escogieron las especies más abundantes (por cobertura o frecuencia); de estas, se recolectaron cinco hojas por individuo (cinco individuos por especie).
Posteriormente se midió el área foliar, el peso fresco y el peso seco para calcular el contenido foliar de materia seca y el área específica de hoja. Adicionalmente se recolectaron muestras de madera, en su mayoría usando la “técnica de la rama”, para realizar el análisis de densidad de madera. El material fue determinado preliminarmente con guías de campo (Pedraza-Peñalosa et al., 2004; Madriñán, 2012) y luego en herbario (Sklenar et al., 2005). Los ejemplares recolectados reposan en los herbarios Federico Medem del Instituto Humboldt y en la Universidad de los Andes.
En el caso de la avifauna se realizaron caminatas de observación y registros auditivos en la misma franja altitudinal de las estaciones definidas. Los muestreos se realizaron en horas de mayor actividad, justo antes del amanecer (05:00 - 06:00 h) hasta las 10:30 h; y en la tarde desde las 15:00 h hasta el atardecer (18:30 h). Se realizaron recorridos altitudinales, cubriendo 80 -100 metros de gradiente altitudinal entre los tipos de cobertura vegetal presentes. La identificación se realizó en terreno con ayuda de guías de campo (Hilty & Brown, 1986; Hilty, 2003; Restall et al., 2007; McMullan et al., 2011).
Adicionalmente, se instalaron redes de niebla en puntos estratégicos para captura de aves. Se utilizaron entre 6 y 15 redes dependiendo del terreno, de 6-12 m de longitud y 2.5 m de altura, y con ojo de malla de 30 o 32 mm. Las redes permanecieron abiertas desde 05:30 -06:00 h hasta 11:00 - 12:00 h, cuando la actividad de las aves disminuyó. Los individuos capturados fueron registrados en un formato de campo, donde se consignó información sobre la determinación taxonómica, sexo, edad, estado reproductivo, estado del plumaje.
Se tomaron rasgos funcionales en el siguiente orden: longitud total del pico, longitud del culmen expuesto, ancho del pico en las narinas, ancho del pico en las comisuras, alto del pico, cuerda alar (longitud del ala), diferencia entre plumas primarias y plumas secundarias del ala, envergadura, área alar, longitud del tarso, longitud del hallux, longitud de la garra del hallux, longitud de la cola, graduación de las plumas de la cola y masa corporal de acuerdo al protocolo descrito en López-Ordoñez et al. (2016). Los especímenes recolectados en el marco de esta investigación se encuentran depositados en la colección de Ornitología del Instituto Humboldt.
Adicionalmente, teniendo en cuenta las asociaciones descritas en Stiles & Rosselli (1998), referentes al comportamiento de forrajeo y la definición de grupos de dieta y las observaciones realizadas en campo, se determinaron las asociaciones con tipo de hábitat-estrato vegetal, con el fin de determinar la afinidad de cada especie de aves con relación a donde se encuentra.
La caracterización de anfibios se desarrolló por medio de caminatas en la misma franja altitudinal de las estaciones preestablecidas. Se realizó una búsqueda libre por encuentro visual azaroso (Heyer et al., 1994) y con ayuda de la técnica de rastrillo (Mueses-Cisneros & Yanez-Muñoz, 2009). Este método, según Rueda-Almonacid et al. (2006), es el más eficiente para obtener el mayor número de especies en el menor tiempo por parte de colectores experimentados. Las búsquedas fueron diurnas y nocturnas revisando minuciosamente en los tipos de microhábitats disponibles (lechos de quebradas, bordes de vegetación, necromasa, troncos en descomposición, rocas, estanques y charcas temporales, entre otros) presentes en las diferentes coberturas vegetales (Heatwole, 1982). La captura de especímenes se realizó manualmente. Estos fueron introducidos en bolsas de tela y plásticas individuales para luego ser medidos y fijados. Los especímenes fueron sacrificados, preparados y fijados en alcohol al 70 % y los tejidos (i. e. fragmento de músculo) fueron almacenados en alcohol al 99 % para futuros análisis. La identificación de los especímenes fue realizada con acceso a literatura especializada y a comparaciones con el material de referencia de la Colección de Anfibios del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia. Todos los especímenes fueron procesados según las técnicas de Simmons (2002) y depositados en las colecciones de anfibios Instituto Humboldt y en la Universidad de los Andes. Las ranas recolectadas fueron fotografiadas y se identificaron en lo posible hasta el nivel de especie. Los reptiles encontrados oportunistamente dentro de los transectos fueron incluidos en la base de datos de levantamiento, pero los aspectos sobre sus rasgos funcionales no se incluyeron, dado que el protocolo se encuentra restringido y diseñado solo para anfibios (Marín et al., 2016).
En el caso de la edafofauna epigea se efectuaron dos procedimientos complementarios. En el primer caso, se instalaron 2 transectos cada uno de 50 m por cada estación altitudinal. Cada uno de los transectos disponía de 11 trampas de caída (5 sin cebo, 3 con cebo de atún para hormigas y 3 con cebo de heces para escarabajos); la distancia mínima entre cada trampa fue de 10 m lineales. La disposición de las trampas con o sin cebo no presentó orden definido. La segunda metodología implicó la recolección directa, buscando durante dos horas diarias dentro de los transectos previamente establecidos. Con el fin de capturar especímenes raros o de baja actividad que no puedan llegar a caer en las trampas, se buscó cuidadosamente en microhábitats con materia orgánica en descomposición (e. g., hojarasca, troncos) y áreas húmedas (Villarreal et al., 2006).
Los especímenes recolectados en las trampas se guardaron y etiquetaron en viales de 10 mL con alcohol al 70 %. Los especímenes de recolecciones directas fueron sacrificados en cámara letal con acetato de etilo para un posterior montaje en alfileres entomológicos (Villarreal et al., 2006). Los grupos de especial interés por sus reconocidas características como bioindicadores fueron los órdenes Araneae, Coleoptera e Hymenoptera. Para estos casos fue necesario el uso de claves especializadas para determinar los ejemplares hasta nivel de familia y con el conocimiento de cada investigador fueron separados por morfoespecies. Los especímenes reposan en las colecciones entomológicas del Instituto Humboldt, la Universidad de los Andes y la Universidad Nacional de Colombia.
Resultados
Descripción de los conjuntos de datos
Los datos evidencian una heterogeneidad en la distribución de las comunidades bióticas en el complejo de páramo a lo largo del gradiente altitudinal.
En general, la mayor riqueza y diversidad vegetal se presentan en la zona de transición entre el bosque altoandino y el páramo bajo. Esta zona se caracteriza estructuralmente por estar dominada por formas arbustivas, con algunos árboles. En cuanto a su composición se pueden encontrar especies propias del bosque altoandino, como Weinmannia tomentosa, Drymis granadensis, Clethra fimbriata y especies características del páramo bajo como Macleania rupestris, Gaultheria anastomosans y Espeletia grandiflora. Registramos dos especies en estado vulnerable (VU) (Hedyosmum parvifolium y Centronia brachycera) y se realizó la descripción de una especie nueva endémica, denominada Puya loca (Madriñán, 2015) cuya distribución probablemente esté restringida a esta zona de estudio, lo cual es característico de sistemas de alta montaña (Steinbauer et al., 2016).
Se registran 38 nuevas familias de artrópodos para para el Complejo de Páramos del PNN Chingaza: 23 para el orden Araneae y 15 para el orden Coleoptera. Los nuevos registros y las familias varían en cada transecto altitudinal, y el sector de Pantano de Martos fue donde se reportaron el mayor número de las nuevas familias registradas: 22, seguida de BioAndina con 20, Sesquilé y Rincón del Oso con 17, y finalmente Tunjaque, con 12.
Las especies de anfibios listadas en el presente trabajo exhiben una distribución restringida, reconocidas como endémicas para Colombia, encontrando algunos casos de endemismo para el norte de la cordillera Oriental entre 2600 y 3900 m s. n. m. en los departamentos de Cundinamarca y Boyacá (Lynch & Renjifo, 2001). Tres posibles novedades taxonómicas se registran durante el presente estudio para la localidad de Guasca (Pantano de Martos, Monquentiva). La primera novedad es una morfoespecie asociada a bromelias presentes en la franja de bosque altoandino (2740 - 2840 m s. n. m). Morfológicamente presenta afinidad con la especie Pristimantis uisae (Lynch, 2003), especie previamente reportada para el flanco occidental de la cordillera Oriental entre 2400 y 2700 m s. n. m. (Acosta-Galvis, 2017). Una segunda posible candidata a nueva especie de Pristimantis, fue encontrada asociada a la franja de bosques altoandinos a 2840 m s. n. m., y es afín a P. savagei (Pyburn & Lynch, 1981), especie endémica, amenazada y previamente registrada para los departamentos de Meta y Cundinamarca en un rango altitudinal entre 600 y 3000 m s. n. m. (Acosta-Galvis, 2017). En cuanto a reptiles, se registraron cuatro especies de alta montaña, pertenecientes al suborden Sauria: Anolis heterodermus, familia Dactyloidae; Stenocercus trachycephalus, familia Tropiduridae; Anadia bogotensis; Riama striata, familia Gymnophthalmidae.
La avifauna reportada en esta investigación representa el 25 % de la diversidad de especies registrada para el complejo de páramo Chingaza, teniendo en cuenta las cifras descritas en Linares-Romero et al. (2017). Allí se encuentran 113 especies andinas, destacándose la presencia de aves nectarívoras (Trochilidae, Thraupidae), insectívoras (Parulidae, Furnariidae), frugívoras (Cotingidae, Thraupidae) y carnívoras (Accipitridae). Asimismo, reportamos taxones que presentan un patrón de distribución restringido desde Cundinamarca hasta el Norte de Santander (Andes orientales de Colombia): Coeligena helianthea, Rallus semiplumbeus, Synallaxis subpudica, Conirostrum rufum y Eriocnemis cupreoventris, aves que habitan áreas altoandinas en un gradiente altitudinal desde 2600 hasta 3500 m s. n. m. asociadas a vegetación de bosque y páramo.
URL de los recursos. Para acceder a la última versión de los conjuntos de datos:
Portal SiB Colombia.
http://datos.biodiversidad.co/dataset/878b1066-ebac-4a81-a852-7db747ba07b9
http://datos.biodiversidad.co/dataset/fbff4768-8f4a-4d48-a821-5b4b491b2275
Nombres
Darwin Core Archive Estudios bióticos (Plantas, Fauna Edáfica, Anfibios y Aves) en el Complejo de Páramos Chingaza Darwin Core Archive Rasgos funcionales de plantas, anfibios y aves de estudios bióticos en el Complejo de Páramos Chingaza
Idioma. Español
URL del archivo. Para acceder a la versión del conjunto de datos descrita en este artículo:http://ipt.biodiversidad.co/biota/resource?r=rrbbchingaza2015
Formato del archivo. Darwin Core
Versión del formato del archivo. 1.0
Nivel de jerarquía. Dataset
Fecha de publicación de los datos. 2017-07-14
Idioma de los metadatos. Español
Fecha de creación de los metadatos. 2016-01-25
Licencia de uso. Creative Commons Attribution Non Commercial (CC-BY-NC) 4.0 License
Agradecimientos
Carlos Sarmiento, Juan Carlos Rey, Beatriz Salgado, Paula Ungar, Andrea Quintana, Claudia Alfonso, Camilo Cadena y Maria Victoria Sarmiento por su acompañamiento. Dairo Escobar y demás integrantes del SiB orientaron la estructuración de los conjuntos de datos. A dos evaluadores anónimos por sus comentarios y sugerencias, a Paula Sánchez D. y Cristina Rueda U. por la asistencia editorial. Igualmente agradecemos a la Familia Escallón (Finca Rodamonte), Familia Avellaneda (Finca Suasié), Antonio Piñeros (Finca Tierraleja) y Orlando Feliciano (Fundación BioAndina). Un agradecimiento especial a los habitantes de la Vereda Monquentiva y los miembros de COOLEGA por su amable hospitalidad en el Pantano de Martos. Katrina Kaur amablemente revisó el inglés. LFHD agradece a Daniela García A. por el apoyo durante el desarrollo del proyecto.
Este proyecto fue financiado mediante el convenio No. 14-13-014-171CE entre Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Universidad de Los Andes. Este convenio se desarrolló en el marco del proyecto: Insumos técnicos para la delimitación de páramos y humedales. Convenio Interadministrativo 005 de 2013 suscrito entre el Fondo Adaptación y el Instituto Humboldt.
Referencias
Acosta Galvis, A. R. (2017). Lista de los anfibios de Colombia: Referencia en línea V.07.2017.0. Página web accesible en http://www.batrachia.com; Batrachia, Villa de Leyva, Boyacá, Colombia.
Amat, G. & Vargas, O. (1991). Caracterización de microhabitats de la artropofauna en páramos del Parque Nacional Natural Chingaza, Cundinamarca, Colombia. Caldasia, 16(79), 539-550.
Anganoy-Criollo, M. & Ramírez, J. P. (2017). New records of Pristimantis carranguerorum (Anura: Craugastoridae) from the Cordillera Oriental of Colombia. Check List, 13(3), 2138.
Bernal, H. Y. & Jiménez, L. C. (1991). Planeamiento para la elaboración de la Flora Fanerogámica del Parque Nacional Natural Chingaza (Cundinamarca, Meta— Colombia). Cuadernos Divulgativos, 3, 1-12.
Cuesta, F., Muriel, P., Llambí, L. D., Halloy, S., Aguirre, N., Beck, S., Carilla, J., Meneses, R. I., Cuello, S., Grau, A. & Gámez, L. E. (2017). Latitudinal and altitudinal patterns of plant community diversity on mountain summits across the tropical Andes. Ecography, 40(12), 1381-1394.
Díaz J., Amat G. D. & Vargas, O. (2007). Caracterización de la artropofauna epigea de zonas intervenidas en los predios del embalse de Chisacá. Pp: 199-214. En Vargas O. (Ed). Restauración ecológica del bosque altoandino. Estudios diagnósticos y experimentales en los alrededores del embalse de Chisacá (Localidad de Usme, Bogotá D.C.). Bogotá: Universidad Nacional de Colombia.
Franco R., P., Rangel Ch., O. & Lozano C., G. (1986). Estudios ecológicos en la Cordillera Oriental–II. Las comunidades vegetales de los alrededores de la Laguna de Chingaza (Cundinamarca). Caldasia, 15(71-75), 219-248.
Heatwole, H. (1982). A review of structuring in herpetofaunal assemblages. En Scott, Jr., N. J. (Ed). Herpetological communities (13). Pp. 1-19. U.S. Fish and Wildlife Service.
Heyer, M. A., Donelly, R. W., Mcdiarmid, L. A., Hayek, C. & Foster, M. S. (1994). Measuring and Monitoring Biological Diversity. Standard Methods for amphibians. Washington D. C.: The Smithsonian Institution Press.
Hilty, S. L. & Brown, W. L. (1986). A guide to the birds of Colombia. New Jersey: Princeton University Press.
Hilty, S. L. (2003). Birds of Venezuela. Princeton, New Jersey: Princeton University Press.
Hoyos, J. M. (1991). Aspectos taxonómicos y microhábitats preferenciales de la herpetofauna de páramo y subpáramo del Parque Natural Nacional Chingaza. Cuadernos Divulgativos. Bogotá, Colombia: Universidad Javeriana.
Instituto Alexander von Humboldt. (2017). Recomendación para la delimitación, por parte del Ministerio de Ambiente y Desarrollo Sostenible, del Complejo de Páramos Chingaza a escala 1:25.000. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt – Fondo Adaptación.
Jiménez, L. C. & Bernal, H. Y. (1991). Flora fanerogámica del Parque Nacional Natural Chingaza I: resultados preliminares. Cuadernos Divulgativos, 15, 1-30.
Laboratorio de Genética de la Conservación. (2014). Protocolo de medición de rasgos funcionales y toma de tejidos en plantas, aves y anfibios de ecosistemas altoandinos. Proyecto Delimitación De Páramos. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Linares-Romero, L. G., Stiles, F. G., Rosselli, L., Camargo P., Candil, J., Galindo-T, R., Avellaneda, F. E. & Pulido, A. R. (2017). Guía de aves del Parque Nacional Natural Chingaza. Bogotá D. C.: La Imprenta Editores.
López-Ordoñez, J. P., Stiles, F. G. & Parra Vergara, J. L. (2016). Protocolo para la medición de rasgos funcionales en aves. En Salgado-Negret, B. (Ed). La ecología funcional como aproximación al estudio, manejo y conservación de la biodiversidad: protocolos y aplicaciones. Pp. 81-125. Bogotá, D. C., Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Lora, C. (1999). El Parque Nacional Natural Chingaza. Trabajo presentado en I Simposio taller de investigación para la región del PNN Chingaza. (25 al 27 de octubre de 1999: PNN Chingaza). Bogotá: Ministerio del Medio Ambiente – Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales, Fundación Natura, Wildlife Conservation Society.
Lynch, J. (1982). Two new species of poison-dart frogs (Colostethus) from Colombia. Herpetologica, 366-374.
Lynch, J. D. (1994). A new species of high-altitude frog (Eleutherodactylus: Leptodactylidae) from the Cordillera Oriental of Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Fisicas y Naturales, 19, 195-203.
Lynch, J. D. (2003). New species of frogs (Eleutherodactylus: Leptodactylidae) from the Cordillera Oriental of Norte de Santander and Santander, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 27(104), 449-460.
Lynch, J. D. & Duellman, W. E. (1980). The Eleutherodactylus of the Amazonian slopes of the Ecuadorian Andes (Anura: Leptodactylidae). Miscellaneous Publication. Museum of Natural History, University of Kansas, 69, 1-86.
Lynch, J. D. & Duellman, W. E. (1997). Frogs of the genus Eleutherodactylus (Anura: Leptodactylidae) in western Ecuador: systematics, ecology, and biogeography. Natural History Museum, University of Kansas, 23, 1-236.
Lynch, J. D. & Renjifo, J. M. (2001). Guía de los anfibios y reptiles de Bogotá y sus alrededores. Bogotá: Impresos Ediciones Ltda. 78 pp.
Lynch, J. D. & Suárez-Mayorga, A. M. (2002). Análisis biogeográfico de los anfibios paramunos. Caldasia, 24, 471-480.
Madriñán, S. (2012). Flora ilustrada del Páramo de Chingaza: guía de campo de plantas comunes. Bogotá: Ediciones Uniandes. 64 pp.
Madriñán, S. (2015). Una nueva especie de Puya (Bromeliaceae) de los páramos cercanos a Bogotá, Colombia. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales, 39(152), 389-398.
Mahecha, G. (1989). Composición florística y usos de algunas especies vegetales de la Reserva Biológica de Carpanta, Municipio de Chuscales-Cundinamarca. Bogotá: Informe Fundación Natura.
Marín, C., Medina, G., Jiménez, D., Sarmiento, V. & Léon, O. (2016). Propuesta metodológica para los estudios bióticos para la identificación y delimitación de los complejos de páramos a escala 1:25.000. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
McMullan, M., Quevedo, A. & Donegan, T. M. (2011). Guia de campo de las aves de Colombia. Bogotá: Fundación ProAves.
Medina-Rangel, G. F. & Lopez-Perilla, Y. R. (2014). Diversidad de anfibios y reptiles en la alta montaña del suroriente de la sabana de Bogotá, Colombia. Herpetotropicos, 10, 17-30.
Mendoza-Roldán, J. S. (2016). Pristimantis nervicus (Lynch’s Nervous Frog) Reproduction. Herpetological Review, 47, 441-442.
Morales-Castaño, I. T. & Amat-García, G.D. (2012). Diversidad de la artropofauna terrestre del páramo La Parada del Viento, Cordillera Oriental, Cundinamarca-Colombia. Boletín de la Sociedad Entomológica Aragonesa, (S.E.A) 51, 211-216.
Mueses-Cisneros, J. J. & Yánez-Muñoz, M. H. (2009). Técnica de remoción con rastrillo y azadón (RRA): una metodología adecuada para una fauna inadecuadamente muestreada, la herpetofauna de la región paramuna. En Vriesendorp, C., Alverson, W. S., Del Campo, Á., Stotz, D. F., Moskovits, D. K., Fuentes Cáceres, S., Coronel Tapia, B. & Anderson, E. P. (Eds). Ecuador: Cabeceras Cofanes-Chingual. Rapid Biological and Social Inventories Report, 21, 284-287.
Navas, C. A. (1999). Biodiversidad de anfibios y reptiles en el páramo: una visión ecofisiológica. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23 (Suplemento especial), 265-474.
Osorno, M. & Ardila, M. C. (2004). Sapito arlequín vientre de fuego. Atelopus subornatus. En Rueda Almonacid, J.V., Lynch, J. D. & Amézquita, A. (Eds.) Libro Rojo de los anfibios de Colombia. Serie de libros rojos de especies amenazadas de Colombia. Pp. 202-205. Bogotá, Colombia: Conservación internacional Colombia, Instituto de Ciencias Naturales Universidad Nacional de Colombia. Ministerio del Medio Ambiente.
Osorno Muñoz, M., Ardila-Robayo, M. C. & Ruiz-Carranza, P. M. (2001). Tres nuevas especies de Atelopus A. M. C. Dumeril & Bibron, 1841 (Amphibia: Bufonidae) de las partes altas de la Cordillera Oriental Colombiana. Caldasia, 23, 509-522.
Pavajeau, L. (1993). Características morfológicas y oferta de frutos para el consumo de las aves del bosque andino de Carpanta. En Andrade, G. I. (Ed.). Selva nublada y páramo. Pp. 97-126. Bogotá: Fundación Natura Colombia.
Pedraza-Peñalosa, P., J. Betancourt & Rosselli, P. F. (2004). Chisacá, un recorrido por los páramos andinos. Bogotá, Colombia: Instituto de Ciencias Naturales e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. 340 pp.
Pyburn, W. F., & Lynch, J. D. (1981). Two little-known species of Eleutherodactylus (Amphibia: Leptodactylidae) from the Sierra de la Macarena, Colombia. Proceedings of the Biological Society of Washington, 94(2), 404-412.
Ramírez, L., Llambí, L. D., Schwarzkopf, T., Gámez, L. E. & Márquez, N. J. (2009). Vegetation structure along the forest-páramo transition belt in the Sierra Nevada de Mérida: Implications for understanding treeline dynamics. Ecotrópicos, 22(2), 83-98.
Rangel-Ch., J. O. (2000). Catálogo florístico de los macizos de Chingaza y Sumapaz. Pp: 563-598. En Rangel-Ch., J. (Ed.) Colombia diversidad biótica III: La región de Vida Paramuna. Bogotá D. C.: Editorial Unibiblos.
Restall, R., Rodner, C. & Lentino, M. (2007). Birds of Northern South America: an identification guide. Volume 1. New Haven: Yale University Press. 880 pp.
Rivera-Correa, M., Lamadrid-Feris, F. & Crawford, A. J. (2016). A new small golden frog of the genus Pristimantis (Anura: Craugastoridae) from an Andean cloud forest of Colombia. Amphibia-Reptilia, 37(2), 153-166.
Rodríguez-Mahecha, J.V. (Ed.) (2005). Ranas arlequines, serie libretas de campo. Colombia: Conservación Internacional. 158 pp.
Rosas, M. L. (1993). Manejo de información en la Reserva Carpanta. En Andrade, G. I. (Ed.). Selva nublada y páramo. Pp. 229-256. Bogotá: Fundación Natura Colombia.
Rueda-Almonacid, J.V. & Hoyos, J. M. (1991). Atelopus muisca, nueva especie de anfibio (Anura: Bufonidae) para el P.N.N. Chingaza, Colombia. Trianea Acta Científica y Tecnológica, 471-480.
Rueda-Almonacid, J. V., Rodríguez-Mahecha, J. V. & La Marca, E. (Eds.). (2006). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo N 2. Bogotá D. C.: Panamericana Formas e Impresos S. A. 298 pp.
Sarmiento, C., Cadena, C., Sarmiento, M. & Zapata, J. (2013). Aportes a la conservación estratégica de los páramos en Colombia: Actualización de la cartografía de los complejos de páramos a escala 1:100.000. Bogotá D. C. Colombia: Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. 87 pp.
Siemann, E., Haarstad, J. & Tilman, D. (1999). Dynamics of plant and arthropod diversity during ald field succession. Ecography, 22, 406-414.
Simmons, J. E. (2002). Herpetological collecting and collections management. Society for the Study of Amphibians and Reptiles. Herpetological Circular, 16, 1-70.
Simpson, B. B. & Todzia, C. A. (1990). Patterns and processes in the development of the high Andean flora. American Journal of Botany, 77, 1419-1432.
Sklenar, P., Luteyn, J. L., Ulloa Ulloa, C., Jorgensen, P. M. & Dillon, M. O. (2005). Flora genérica de los páramos: guía ilustrada de las plantas vasculares. Memoirs of the New York Botanical Garden, 92. New York: New York Botanical Garden Press. 499 pp.
Steinbauer, M. J., Field, R., Grytnes, J. A., Trigas, P., Ah-Peng, C., Attorre, F., Birks, H. J. B., Borges, P. A., Cardoso, P., Chou, C. H. & De Sanctis, M. (2016). Topography-driven isolation, speciation and a global increase of endemism with elevation. Global Ecology and Biogeography, 25, 1097-1107.
Stiles, F. G. & Roselli, L. (1998). Inventario de las aves de un bosque altoandino: comparación de dos métodos. Caldasia, 20(1), 29-43.
Suárez-Mayorga, A. M. (1999). Lista Preliminar de la fauna Amphibia presente en el transecto la Montañita-Alto de Gabinete, Caquetá, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23, 395-405.
Suárez-Mayorga, A. & Lynch, J. D. (2008). Anfibios de la región del transecto Sumapaz. En Van der Hammen, T. (Ed.). La cordillera Oriental colombiana. Transecto Sumapaz. Pp. 311-326. Studies on Tropical Andean Ecosystems. Volumen 7.
Vaira, M. (2001). Distribución espacial de una comunidad de anuros de las Yungas andinas de Argentina. Cuadernos en Herpetología, 15, 45- 47
Vargas Ríos, O. & Pedraza, P. (2003). El Parque Nacional Natural Chingaza. Universidad Nacional de Colombia Facultad de Ciencias, Departamento de Biología. 12 pp.
Villarreal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M. & Umaña, A. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de inventarios de biodiversidad. Segunda edición. Bogotá: Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. 235 pp.
References
Acosta Galvis, A. R. (2017). Lista de los anfibios de Colombia: Referencia en línea V.07.2017.0. Página web accesible en http://www.batrachia.com; Batrachia, Villa de Leyva, Boyacá, Colombia.
Amat, G. & Vargas, O. (1991). Caracterización de microhabitats de la artropofauna en páramos del Parque Nacional Natural Chingaza, Cundinamarca, Colombia. Caldasia, 16(79), 539-550.
Anganoy-Criollo, M. & Ramírez, J. P. (2017). New records of Pristimantis carranguerorum (Anura: Craugastoridae) from the Cordillera Oriental of Colombia. Check List, 13(3), 2138.
Bernal, H. Y. & Jiménez, L. C. (1991). Planeamiento para la elaboración de la Flora Fanerogámica del Parque Nacional Natural Chingaza (Cundinamarca, Meta— Colombia). Cuadernos Divulgativos, 3, 1-12.
Cuesta, F., Muriel, P., Llambí, L. D., Halloy, S., Aguirre, N., Beck, S., Carilla, J., Meneses, R. I., Cuello, S., Grau, A. & Gámez, L. E. (2017). Latitudinal and altitudinal patterns of plant community diversity on mountain summits across the tropical Andes. Ecography, 40(12), 1381-1394.
Díaz J., Amat G. D. & Vargas, O. (2007). Caracterización de la artropofauna epigea de zonas intervenidas en los predios del embalse de Chisacá. Pp: 199-214. En Vargas O. (Ed). Restauración ecológica del bosque altoandino. Estudios diagnósticos y experimentales en los alrededores del embalse de Chisacá (Localidad de Usme, Bogotá D.C.). Bogotá: Universidad Nacional de Colombia.
Franco R., P., Rangel Ch., O. & Lozano C., G. (1986). Estudios ecológicos en la Cordillera Oriental–II. Las comunidades vegetales de los alrededores de la Laguna de Chingaza (Cundinamarca). Caldasia, 15(71-75), 219-248.
Heatwole, H. (1982). A review of structuring in herpetofaunal assemblages. En Scott, Jr., N. J. (Ed). Herpetological communities (13). Pp. 1-19. U.S. Fish and Wildlife Service.
Heyer, M. A., Donelly, R. W., Mcdiarmid, L. A., Hayek, C. & Foster, M. S. (1994). Measuring and Monitoring Biological Diversity. Standard Methods for amphibians. Washington D. C.: The Smithsonian Institution Press.
Hilty, S. L. & Brown, W. L. (1986). A guide to the birds of Colombia. New Jersey: Princeton University Press.
Hilty, S. L. (2003). Birds of Venezuela. Princeton, New Jersey: Princeton University Press.
Hoyos, J. M. (1991). Aspectos taxonómicos y microhábitats preferenciales de la herpetofauna de páramo y subpáramo del Parque Natural Nacional Chingaza. Cuadernos Divulgativos. Bogotá, Colombia: Universidad Javeriana.
Instituto Alexander von Humboldt. (2017). Recomendación para la delimitación, por parte del Ministerio de Ambiente y Desarrollo Sostenible, del Complejo de Páramos Chingaza a escala 1:25.000. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt – Fondo Adaptación.
Jiménez, L. C. & Bernal, H. Y. (1991). Flora fanerogámica del Parque Nacional Natural Chingaza I: resultados preliminares. Cuadernos Divulgativos, 15, 1-30.
Laboratorio de Genética de la Conservación. (2014). Protocolo de medición de rasgos funcionales y toma de tejidos en plantas, aves y anfibios de ecosistemas altoandinos. Proyecto Delimitación De Páramos. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Linares-Romero, L. G., Stiles, F. G., Rosselli, L., Camargo P., Candil, J., Galindo-T, R., Avellaneda, F. E. & Pulido, A. R. (2017). Guía de aves del Parque Nacional Natural Chingaza. Bogotá D. C.: La Imprenta Editores.
López-Ordoñez, J. P., Stiles, F. G. & Parra Vergara, J. L. (2016). Protocolo para la medición de rasgos funcionales en aves. En Salgado-Negret, B. (Ed). La ecología funcional como aproximación al estudio, manejo y conservación de la biodiversidad: protocolos y aplicaciones. Pp. 81-125. Bogotá, D. C., Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Lora, C. (1999). El Parque Nacional Natural Chingaza. Trabajo presentado en I Simposio taller de investigación para la región del PNN Chingaza. (25 al 27 de octubre de 1999: PNN Chingaza). Bogotá: Ministerio del Medio Ambiente – Unidad Administrativa Especial del Sistema de Parques Nacionales Naturales, Fundación Natura, Wildlife Conservation Society.
Lynch, J. (1982). Two new species of poison-dart frogs (Colostethus) from Colombia. Herpetologica, 366-374.
Lynch, J. D. (1994). A new species of high-altitude frog (Eleutherodactylus: Leptodactylidae) from the Cordillera Oriental of Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Fisicas y Naturales, 19, 195-203.
Lynch, J. D. (2003). New species of frogs (Eleutherodactylus: Leptodactylidae) from the Cordillera Oriental of Norte de Santander and Santander, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 27(104), 449-460.
Lynch, J. D. & Duellman, W. E. (1980). The Eleutherodactylus of the Amazonian slopes of the Ecuadorian Andes (Anura: Leptodactylidae). Miscellaneous Publication. Museum of Natural History, University of Kansas, 69, 1-86.
Lynch, J. D. & Duellman, W. E. (1997). Frogs of the genus Eleutherodactylus (Anura: Leptodactylidae) in western Ecuador: systematics, ecology, and biogeography. Natural History Museum, University of Kansas, 23, 1-236.
Lynch, J. D. & Renjifo, J. M. (2001). Guía de los anfibios y reptiles de Bogotá y sus alrededores. Bogotá: Impresos Ediciones Ltda. 78 pp.
Lynch, J. D. & Suárez-Mayorga, A. M. (2002). Análisis biogeográfico de los anfibios paramunos. Caldasia, 24, 471-480.
Madriñán, S. (2012). Flora ilustrada del Páramo de Chingaza: guía de campo de plantas comunes. Bogotá: Ediciones Uniandes. 64 pp.
Madriñán, S. (2015). Una nueva especie de Puya (Bromeliaceae) de los páramos cercanos a Bogotá, Colombia. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales, 39(152), 389-398.
Mahecha, G. (1989). Composición florística y usos de algunas especies vegetales de la Reserva Biológica de Carpanta, Municipio de Chuscales-Cundinamarca. Bogotá: Informe Fundación Natura.
Marín, C., Medina, G., Jiménez, D., Sarmiento, V. & Léon, O. (2016). Propuesta metodológica para los estudios bióticos para la identificación y delimitación de los complejos de páramos a escala 1:25.000. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
McMullan, M., Quevedo, A. & Donegan, T. M. (2011). Guia de campo de las aves de Colombia. Bogotá: Fundación ProAves.
Medina-Rangel, G. F. & Lopez-Perilla, Y. R. (2014). Diversidad de anfibios y reptiles en la alta montaña del suroriente de la sabana de Bogotá, Colombia. Herpetotropicos, 10, 17-30.
Mendoza-Roldán, J. S. (2016). Pristimantis nervicus (Lynch’s Nervous Frog) Reproduction. Herpetological Review, 47, 441-442.
Morales-Castaño, I. T. & Amat-García, G.D. (2012). Diversidad de la artropofauna terrestre del páramo La Parada del Viento, Cordillera Oriental, Cundinamarca-Colombia. Boletín de la Sociedad Entomológica Aragonesa, (S.E.A) 51, 211-216.
Mueses-Cisneros, J. J. & Yánez-Muñoz, M. H. (2009). Técnica de remoción con rastrillo y azadón (RRA): una metodología adecuada para una fauna inadecuadamente muestreada, la herpetofauna de la región paramuna. En Vriesendorp, C., Alverson, W. S., Del Campo, Á., Stotz. D. F., Moskovits, D. K., Fuentes Cáceres, S., Coronel Tapia, B. & Anderson, E. P. (Eds). Ecuador: Cabeceras Cofanes-Chingual. Rapid Biological and Social Inventories Report, 21, 284-287.
Navas, C. A. (1999). Biodiversidad de anfibios y reptiles en el páramo: una visión ecofisiológica. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23 (Suplemento especial), 265-474.
Osorno, M. & Ardila, M. C. (2004). Sapito arlequín vientre de fuego. Atelopus subornatus. En Rueda Almonacid, J.V., Lynch, J. D. & Amézquita, A. (Eds.) Libro Rojo de los anfibios de Colombia. Serie de libros rojos de especies amenazadas de Colombia. Pp. 202-205. Bogotá, Colombia: Conservación internacional Colombia, Instituto de Ciencias Naturales Universidad Nacional de Colombia. Ministerio del Medio Ambiente.
Osorno Muñoz, M., Ardila-Robayo, M. C. & Ruiz-Carranza, P. M. (2001). Tres nuevas especies de Atelopus A. M. C. Dumeril & Bibron, 1841 (Amphibia: Bufonidae) de las partes altas de la Cordillera Oriental Colombiana. Caldasia, 23, 509-522.
Pavajeau, L. (1993). Características morfológicas y oferta de frutos para el consumo de las aves del bosque andino de Carpanta. En Andrade, G. I. (Ed.). Selva nublada y páramo. Pp. 97-126. Bogotá: Fundación Natura Colombia.
Pedraza-Peñalosa, P., J. Betancourt & Rosselli, P. F. (2004). Chisacá, un recorrido por los páramos andinos. Bogotá, Colombia: Instituto de Ciencias Naturales e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. 340 pp.
Pyburn, W. F., & Lynch, J. D. (1981). Two little-known species of Eleutherodactylus (Amphibia: Leptodactylidae) from the Sierra de la Macarena, Colombia. Proceedings of the Biological Society of Washington, 94(2), 404-412.
Ramírez, L., Llambí, L. D., Schwarzkopf, T., Gámez, L. E. & Márquez, N. J. (2009). Vegetation structure along the forest-páramo transition belt in the Sierra Nevada de Mérida: Implications for understanding treeline dynamics. Ecotrópicos, 22(2), 83-98.
Rangel-Ch., J. O. (2000). Catálogo florístico de los macizos de Chingaza y Sumapaz. Pp: 563-598. En Rangel-Ch., J. (Ed.) Colombia diversidad biótica III: La región de Vida Paramuna. Bogotá D. C.: Editorial Unibiblos.
Restall, R., Rodner, C. & Lentino, M. (2007). Birds of Northern South America: an identification guide. Volume 1. New Haven: Yale University Press. 880 pp.
Rivera-Correa, M., Lamadrid-Feris, F. & Crawford, A. J. (2016). A new small golden frog of the genus Pristimantis (Anura: Craugastoridae) from an Andean cloud forest of Colombia. Amphibia-Reptilia, 37(2), 153-166.
Rodríguez-Mahecha, J.V. (Ed.) (2005). Ranas arlequines, serie libretas de campo. Colombia: Conservación Internacional. 158 pp.
Rosas, M. L. (1993). Manejo de información en la Reserva Carpanta. En Andrade, G. I. (Ed.). Selva nublada y páramo. Pp. 229-256. Bogotá: Fundación Natura Colombia.
Rueda-Almonacid, J.V. & Hoyos, J. M. (1991). Atelopus muisca, nueva especie de anfibio (Anura: Bufonidae) para el P.N.N. Chingaza, Colombia. Trianea Acta Científica y Tecnológica, 471-480.
Rueda-Almonacid, J. V., Rodríguez-Mahecha, J. V. & La Marca, E. (Eds.). (2006). Técnicas de inventario y monitoreo para los anfibios de la región tropical andina. Conservación Internacional. Serie Manuales de Campo N 2. Bogotá D. C.: Panamericana Formas e Impresos S. A.298 pp.
Sarmiento, C., Cadena, C., Sarmiento, M. & Zapata, J. (2013). Aportes a la conservación estratégica de los páramos en Colombia: Actualización de la cartografía de los complejos de páramos a escala 1:100.000. Bogotá D. C. Colombia: Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. 87 pp.
Siemann, E., Haarstad, J. & Tilman, D. (1999). Dynamics of plant and arthropod diversity during ald field succession. Ecography, 22, 406-414.
Simmons, J. E. (2002). Herpetological collecting and collections management. Society for the Study of Amphibians and Reptiles. Herpetological Circular, 16, 1-70.
Simpson, B. B. & Todzia, C. A. (1990). Patterns and processes in the development of the high Andean flora. American Journal of Botany, 77, 1419-1432.
Sklenar, P., Luteyn, J. L., Ulloa Ulloa, C., Jorgensen, P. M. & Dillon, M. O. (2005). Flora genérica de los páramos: guía ilustrada de las plantas vasculares. Memoirs of the New York Botanical Garden, 92. New York: New York Botanical Garden Press. 499 pp.
Steinbauer, M. J., Field, R., Grytnes, J. A., Trigas, P., Ah-Peng, C., Attorre, F., Birks, H. J. B., Borges, P. A., Cardoso, P., Chou, C. H. & De Sanctis, M. (2016). Topography-driven isolation, speciation and a global increase of endemism with elevation. Global Ecology and Biogeography, 25, 1097-1107.
Stiles, F. G. & Roselli, L. (1998). Inventario de las aves de un bosque altoandino: comparación de dos métodos. Caldasia, 20(1), 29-43.
Suárez-Mayorga, A. M. (1999). Lista Preliminar de la fauna Amphibia presente en el transecto la Montañita-Alto de Gabinete, Caquetá, Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 23, 395-405.
Suárez-Mayorga, A. & Lynch, J. D. (2008). Anfibios de la región del transecto Sumapaz. En Van der Hammen, T. (Ed.). La cordillera Oriental colombiana. Transecto Sumapaz. Pp. 311-326. Studies on Tropical Andean Ecosystems. Volumen 7.
Vaira, M. (2001). Distribución espacial de una comunidad de anuros de las Yungas andinas de Argentina. Cuadernos en Herpetología, 15, 45- 47
Vargas Ríos, O. & Pedraza, P. (2003). El Parque Nacional Natural Chingaza. Universidad Nacional de Colombia Facultad de Ciencias, Departamento de Biología. 12 pp.
Villarreal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M. & Umaña, A. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Programa de inventarios de biodiversidad. Segunda edición. Bogotá: Instituto de Investigaciones de Recursos Biológicos Alexander von Humboldt. 235 pp.
How to Cite
The works published in the journals of the Alexander von Humboldt Biological Resources Research Institute are subject to the following terms, in relation to copyright:
1. The patrimonial rights of the published works are assigned to Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. The authors or institutions that elaborate the document agree to transfer the patrimonial rights to the Humboldt Institute with the sending of their articles, which allows, among other things, the reproduction, public communication, dissemination and dissemination of works.
2. The works of digital editions are published under a Creative Commons Colombia license:
Creative Commons License
This work is licensed under a Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional.
> Attribution - Non-commercial - No Derivative: This license is the most restrictive of the six main licenses, it only allows others to download the works and share them with others, as long as their authorship is acknowledged, but they cannot be changed in any way, nor can they be used commercially.
3. The authors, when submitting articles to the editorial process of the magazines published by the Humboldt Institute, accept the institutional dispositions on copyright and open access.
4. All items received will be subjected to anti-plagiarism software. The submission of an article to the magazines of the Humboldt Institute is understood as the acceptance of the review to detect possible plagiarism.
5. The works submitted to the editing process of the magazines of the Humboldt Institute must be unpublished.